
| A. | CO(g)+2H2(g)═CH3OH(l) | |
| B. | 2Cu(s)+O2(g)═2CuO(s) | |
| C. | NH3(g)+HCl(g)═NH4Cl(s) | |
| D. | CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l) |
分析 熵描述的是体系的混乱度,熵增加就是混乱程度增大的反应,反应中若生成气体或气体的量增加,都会使混乱度增加,熵增加据此解答.
解答 解:A.反应CO(g)+2H2(g)═CH3OH(l)是气体减少的反应,是熵减的反应,故A错误;
B.2Cu(s)+O2(g)═2CuO(s)反应前有气体,反应后无气体,是熵减的反应,故B错误;
C.NH3(g)+HCl(g)═NH4Cl(s),该反应是气体减少的反应,是熵减的反应,故C错误;
D.CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l),反应物中有液体和固体,生成物中有气体生成,是熵显著增加的反应,故D正确;
故选D.
点评 本题考查了熵增过程的判断,解题关键抓住熵增的含义,反应气体量增多则体现混乱度增大,题目难度不大,侧重于考查学生对有关知识的应用能力.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | N2为0.2mol/L,H2为0.6mol/L | B. | N2为0.15mol/L | ||
| C. | N2、H2均为0.18mol/L | D. | NH3均为0.18mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
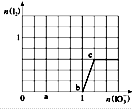
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
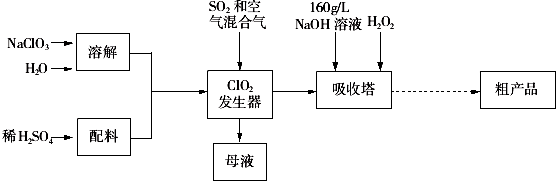
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
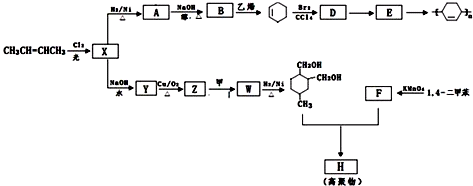
 (或写成
(或写成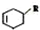 R代表取代基或氢)
R代表取代基或氢)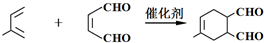 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com