
| A、镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
| B、同一原子中,2p,3p,4p能级的轨道依次增多 |
| C、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| D、CH2O和ClO4-的中心原子上都含有孤对电子 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
| A、IA | B、ⅢA | C、ⅤA | D、ⅦA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+ 1s22s22p63s23p6 |
| B、F- 1s22s23p6 |
| C、S2- 1s22s22p63s23p4 |
| D、Ar 1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
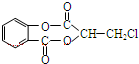 )在一定条件下可以发生如图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如图所示的转化(其他产物和水已略去).
查看答案和解析>>
科目:高中化学 来源: 题型:
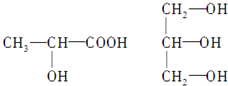
查看答案和解析>>
科目:高中化学 来源: 题型:
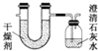 已知某种燃料含有碳、氢二种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
已知某种燃料含有碳、氢二种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、F-的电子排布图: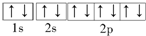 |
B、Na+的结构示意图: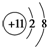 |
| C、Mg2+的电子排布式:1s22s22p6 |
| D、Cr的简化电子排布式:[Ar]3d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2D | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
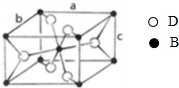 ,该氧化物的化学式为
,该氧化物的化学式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com