
 3,3-二乙基戊烷;
3,3-二乙基戊烷; ;
;分析 (1)根据烷烃的系统命名法:选主链、编号、合并取代基、写名称来回答;
(2)键线式是将有机物中的C原子用端点和拐点来代替,将C原子上的H原子省略所得到的式子;
(3)甘油是丙三醇;
(4)0.3molB2H6气体在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,则1molB2H6完全反应放出2165 kJ热量,据此书写热化学反应方程式.
解答 解:(1)根据有机物的命名原则,(CH3CH2)2C(CH2CH3)2的最长碳链是5个碳原子,为戊烷,编号离取代基最近的原则,则3号位上有两个乙基,所以名称为3,3-二乙基戊烷,故答案为:3,3-二乙基戊烷;
(2)键线式是将有机物中的C原子用端点和拐点来代替,将C原子上的H原子省略所得到的式子,故1-丙醇CH3CH2CH2OH的键线式为 ,故答案为:
,故答案为: ;
;
(3)甘油的结构简式:CH2OH-CHOH-CH2OH,故答案为:CH2OH-CHOH-CH2OH,故答案为:CH2OH-CH(OH)-CH2OH;
(4)0.3molB2H6气体在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,则1molB2H6完全反应放出2165 kJ热量,则该热化学反应方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165 kJ•mol-1 ,
故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165 kJ•mol-1 .
点评 本题考查烷烃、醇的命名和热化学方程式书写方法,题目难度中等,掌握基础是解题关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )
2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )| A. | Al粉作为氧化剂 | B. | Al被氧化 | C. | Al发生还原反应 | D. | Al得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的电子式: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 尿素[CO(NH2)2]是一种有机物 | D. | 聚丙烯的化学式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| a转化为b | a转化为c | c转化为b | |
| A | NaOH | Na | CO2 |
| B | Na2CO3 | NaOH | HCl |
| C | NaHCO3 | NaOH | CO2 |
| D | NaHCO3 | Na | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
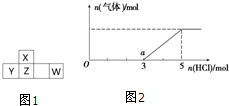 短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.
短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使品红、酸性高锰酸钾溶液褪色,分别体现了它的漂白性和还原性 | |
| B. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已经变质 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加盐酸,沉淀不溶解,说明该溶液中一定存在SO42- | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
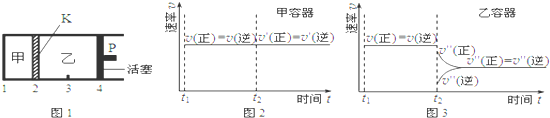
| A. | 保持活塞位置不变,降低温度,达到新的平衡后,甲、乙中B的体积分数均增大 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com