
 实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:| 苯 | 溴 | 溴苯 | |
| 密度/g.cm3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 .
.分析 本题是利用苯和液溴在三溴化铁作催化剂的条件下,在三颈烧瓶内发生取代反应制备溴苯,涉及了反应原理的考查,反应过程中为防止液溴和苯的挥发,提高原料利用率,用冷凝管进行冷凝回流,同时吸收生成的HBr气体,防污染;反应后的混合物通过过滤除去多余的铁粉,然后用氢氧化钠溶液洗去没有反应的溴及生成的HBr,然后通过分液、蒸馏进行分离提纯;
(1)根据常见仪器的结构可推断出仪器c的名称,反应是放热反应,参加反应的溴和苯都易挥发,C装置的作用应该是冷凝并使溴和基本重新流回三颈烧瓶内;
(2)苯与液溴反应生成HBr,HBr遇水蒸气形成白雾;苯和液溴在催化剂溴化铁的作用下发生取代反应生成溴苯和溴化氢;
(3)根据溴苯中含有溴,单质溴能与NaOH溶液反应生成NaBr和NaBrO溶于水中,而溴苯不与NaOH溶液反应,也不溶于水,分液后,然后加干燥剂,据此解答;
(4)根据分离出的粗溴苯中含有未反应的苯,分离互溶的液体,利用沸点不同,可采用蒸馏的方法进行分离.
解答 解:(1)仪器C是球形冷凝管,使用装置的目的是使挥发的溴和苯经冷凝后重新回到反应容器内,提高原料利用率,故答案为:球形冷凝管;冷凝、回流;
(2)苯与液溴反应生成HBr,HBr遇水蒸气形成白雾;c中发生反应的化学方程式为2Fe+3Br2═2FeBr3 ,故答案为:HBr;2Fe+3Br2═2FeBr3
,故答案为:HBr;2Fe+3Br2═2FeBr3 ;
;
(3)溴苯提纯的方法是:①先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,②加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中,故答案为:除去HBr和未反应的Br2;
③加干燥剂,无水氯化钙能干燥溴苯,故答案为:干燥;
(4)反应后得到的溴苯中溶有少量未反应的苯,苯和溴苯互溶,但苯的沸点低,所以采用蒸馏的方法进行分离,溴苯留在母液中,故答案为:苯;蒸馏.
点评 本题主要考查了溴苯的制取实验、物质的分离提纯等,清楚制备的原理是解答的关键,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.12g | B. | 3.51g | C. | 4.22g | D. | 5.28g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: )你认为该装置中可以加入苯或CCl4液体.
)你认为该装置中可以加入苯或CCl4液体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 |
| K | 0.6 | 0.9 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

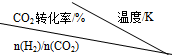 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯水中通入二氧化硫,氯水的漂白性增强 | |
| B. | 氯水中加入NaCl固体,对溶液的pH无影响 | |
| C. | 常温下,pH=2的氯水中:c (Cl-)+c ( ClO-)+c (OH -)=0.01mol•L-1 | |
| D. | 向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-═2CO2↑+Cl -+ClO -+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)
(1)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com