
| A. | 锥形瓶可用作加热的反应器 | |
| B. | 室温下,不能将浓硫酸盛放在铁桶中 | |
| C. | 在50mL量筒中配置0.1000mol•L-1碳酸钠溶液 | |
| D. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 |
分析 A.锥形瓶可间接加热;
B.常温下,Fe遇浓硫酸发生钝化;
C.不能在量筒中配制溶液;
D.pH试纸测定pH,不能湿润,若湿润可能无影响.
解答 解:A.锥形瓶可间接加热,则锥形瓶可用作加热的反应器,如固体与液体反应的加热,故A正确;
B.常温下,Fe遇浓硫酸发生钝化,则室温下,能将浓硫酸盛放在铁桶中,故B错误;
C.不能在量筒中配制溶液,量筒只能量取液体,故C错误;
D.pH试纸测定pH,不能湿润,若湿润可能无影响,如测定NaCl溶液的pH,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、物质的性质、pH测定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
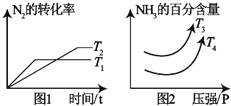 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:| 化学键 | N≡N | H-H | N-H |
| 键能/kJ/mol | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 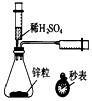 测定一定时间内生成H2的反应速率 | B. | 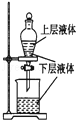 提取海带中的碘 | ||
| C. | 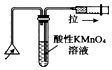 检验火柴燃烧产生的SO2 | D. | 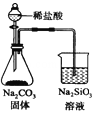 证明非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
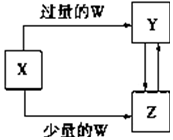 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 稀硫酸 | NaAlO2溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com