
| A. | 若不考虑HClO和H20的电离,该溶液中H+的浓度为0.1mol/L | |
| B. | 若在该溶液中加入足量Na0H,则可得到0.1mol的NaClO | |
| C. | 若将此溶液在强光下光照,产生气泡,则气泡主要成分是O2 | |
| D. | 此溶液久置后,由于HClO的大量分解,会导致其pH值升高 |
分析 常温下将0.1mol的Cl2通入0.5L的水中(不计溶液体积变化),制得氯水,发生反应:Cl2+H2O?HCl+HClO,然后滴加NaOH,发生反应:HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,
A.该反应为可逆反应;
B.NaClO为强碱弱酸盐;
C.次氯酸不稳定性,在光照条件下发生:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2;
D.由于HClO的分解导致了Cl2的不断反应,最后变成了HCl溶液,弱酸变成强酸,溶液酸性增强.
解答 解:常温下将0.1mol的Cl2通入0.5L的水中(不计溶液体积变化),制得氯水,发生反应:Cl2+H2O?HCl+HClO,
A.该反应为可逆反应,生成的HCl的物质的量小于0.1mol,若不考虑HClO和H20的电离,该溶液中H+的浓度为小于0.2mol/L,故A错误;
B.NaClO为强碱弱酸盐,发生水解,所以生成的NaClO的物质的量小于0.1mol,故B错误;
C.若将此溶液在强光下光照,发生反应:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,则气泡主要成分是O2,故C正确;
D.此溶液久置后,由于HClO的分解导致了Cl2的不断反应,最后变成了HCl溶液,弱酸变成强酸,溶液酸性增强,会导致其pH值减小,故D错误;
故选C.
点评 本题综合考查氯气的性质,题目难度中等,明确溶液中的溶质及其性质是解本题关键,注意盐类水解原理的应用方法.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:多选题
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:W>Z | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H 5OH+3O2═2CO2+3H 2O△H=-29.7 kJ/mol -1 | |
| B. | C2H 5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol -1 | |
| C. | C 2 H 5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol-1 | |
| D. | C2H 5OH(l)+3O2 (g)═2CO 2 (g)+3H 2 O(l)△H=-1366.2kJ/mol -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
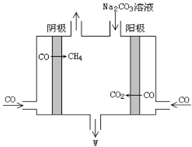 (1)利用CO2与H2反应可合成二甲醚(CH3OCH3).以KOH为电解质溶液,组成二甲醚--空气燃料电池,该电池工作时其负极反应式是CH3OCH3-12e-+16OH-=2CO32-+11H2O.
(1)利用CO2与H2反应可合成二甲醚(CH3OCH3).以KOH为电解质溶液,组成二甲醚--空气燃料电池,该电池工作时其负极反应式是CH3OCH3-12e-+16OH-=2CO32-+11H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,形成过程
,形成过程 ;
;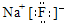 ,形成过程
,形成过程 ;
; ,形成过程
,形成过程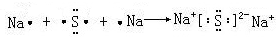 ;
; ;
; ,形成过程
,形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀硫酸中加硫酸钾溶液 | B. | 将锌粒制成薄锌片 | ||
| C. | 向稀硫酸中加碳酸钠固体 | D. | 向稀硫酸中加硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
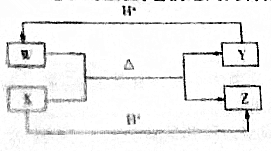
| A. | W的电子式为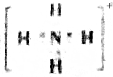 | |
| B. | Y与Z之间可形成氢键 | |
| C. | 硫酸与氢氧化钠溶液反应的离子方程式可表示为X+H+=Z | |
| D. | 微粒Y中各元素原子均达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com