
分析 加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,根据n=$\frac{V}{{V}_{m}}$计算二氧化碳的物质的量,根据方程式计算碳酸氢钠物质的量,再根据m=nM计算碳酸氢钠的质量,进而计算原混合物中碳酸钠的质量,再根据质量分数定义计算混合物中碳酸钠的质量分数,根据质量守恒定律计算出剩余固体的质量.
解答 解:得到气体5.6L(标准状况)为二氧化碳,其物质的量:$\frac{5.6L}{22.4L/mol}$=0.25mol,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
2 1
n(NaHCO3) 0.25mol
则n(NaHCO3)=$\frac{0.25mol×2}{1}$=0.5mol
故m(NaHCO3)=0.5mol×84g/mol=42g
则碳酸钠的质量为:95g-42g=53g,
故碳酸钠的质量分数=$\frac{53g}{95}$×100%=55.8%;
0.5mol碳酸氢钠加热完全分解生成0.25mol碳酸钠,
则剩余固体的质量为:106g/mol×0.25mol+53g=79.5g,
答:混合物中碳酸钠去的质量分数55.8%;剩余固体的质量为79.5g.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积等之间的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的密度都比水小 | |
| B. | 碱金属单质都是还原剂 | |
| C. | 碱金属单质的熔沸点一般随着原子的电子层数的增多而升高 | |
| D. | 碱金属单质在氧气中燃烧,产物都是过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
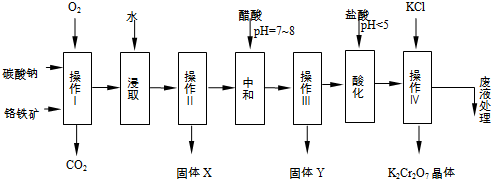
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水只含Cl2和H2O两种分子 | B. | 氢氟酸不能贮放在玻璃瓶里 | ||
| C. | 光导纤维的主要成分是二氧化硅 | D. | 浓硫酸用铁制容器密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com