
分析 甲烷和氯气的反应需要在光照下发生,或用高压汞灯的紫外线照射,KMnO4和浓盐酸之间反应可以产生氯气,甲烷和氯气在光照下发生取代反应产物是有机物以及氯化氢,据此回答即可.
解答 解:(1)甲烷和氯气的反应需要在光照下发生,或用高压汞灯的紫外线照射,KMnO4和浓盐酸之间反应可以产生氯气,甲烷和氯气在光照下发生取代反应产物是有机物以及氯化氢,现象是:没有包黑纸的试管内黄绿色气体变浅,试管壁出现油滴,包黑纸的试管内无现象,答:没有包黑纸的试管内黄绿色气体变浅,试管壁出现油滴,包黑纸的试管内无现象;
(2)甲烷和氯气的反应需要在光照下发生,没有光照或是用高压汞灯的紫外线照射反应不会发生,答:甲烷和氯气的反应需要在光照下发生,没有光照或是用高压汞灯的紫外线照射反应不会发生;
(3)从所得实验信息中得到甲烷和氯气的反应需要在光照下发生的启示,答:甲烷和氯气的反应需要在光照下发生;
(4)甲烷中的氢原子可以被氯气中的氯原子代替,得到卤代烃,根据被取代的氢原子数目的不同,而得到不同的取代产物,
答:甲烷中的氢原子可以被氯气中的氯原子代替,得到卤代烃,同时下来的氢原子和氯原子结合成HCl,根据被取代的氢原子数目的不同,得到不同的取代产物.
点评 本题考查学生家玩的化学性质:甲烷和氯气之间的取代反应,注意反应发生的条件以及反应的产物和伴随的现象是关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. |  制取少量H2 | |
| B. |  分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. |  验证Na和水反应为放热效应 | |
| D. |  收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 若负载为铅蓄电池,则在对铅蓄电池充电时与Cu极相连的一极发生还原反应. | |
| C. | 通空气时时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
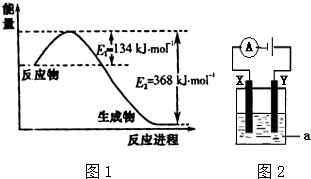
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①③④⑤ | C. | ②③⑤ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加人Na2SO4固体,c(Ba2+)增大 | |
| C. | 含1molKOH的溶液与lmolCO2完全反应后,溶液中c(K+ )=c (HCO3- ) | |
| D. | 改变条件使醋酸溶液中的醋酸根离子浓度增大,溶液的pH值可能减小也可能增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com