
| 实验 | 向试管中加2mL溶液 | 实验现象 |
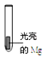 | 实验I:0.1 mol/L AgNO3溶液 | 镁条表面迅速覆盖一层疏松黑色固体,并有少量气泡产生 |
| 实验II:2.0 mol/L NH4Cl溶液 | 反应开始时产生大量气体(经检验其中含有H2),一段时间后产生使湿润的红色石蕊试纸变蓝的气体 | |
| 实验III:pH=8.2 NaHCO3溶液 | 产生大量气体(经检验其中含有H2和CO2)和白色固体 |
| 实验 | 操作 | 现象 |
| 实验IV | 向装有相同镁条的试管中加入2mL1.0mol/L (NH4)2SO4溶液 | 产生气体的速率明显慢于实验II |
分析 (1)①推测实验Ⅰ中黑色固体为Ag,则是镁和硝酸银溶液发生置换反应;
②确认黑色固体为Ag,需要硝酸溶解银为银离子,加入氯化钠检验银离子的存在;
(2)①2.0 mol/L NH4Cl溶液和镁反应,反应开始时产生大量气体(经检验其中含有H2),铵根离子水解显酸性;
②一段时间后产生使湿润的红色石蕊试纸变蓝的气体为氨气;
③向装有相同镁条的试管中加入2mL1.0mol/L (NH4)2SO4溶液,产生气体的速率明显慢于实验II,SO42-不利于Mg和铵盐溶液反应产生H2 ;
(3)②推测在pH=8.2的该溶液中,若无HCO3-,则H+和Mg反应的程度很小,验证此现象可以选取PH=8的氢氧化钠溶液检验是否和镁反应;
(4)影响Mg与盐溶液反应多样性的原因是离子的氧化性、生成物的溶解性、阴离子的影响等.
解答 解:(1)①推测实验Ⅰ中黑色固体为Ag,则是镁和硝酸银溶液发生置换反应,发生反应的离子方程式为:2Ag++Mg=2Ag+Mg2+,
故答案为:2Ag++Mg=2Ag+Mg2+;
②确认黑色固体为Ag,需要硝酸溶解银为银离子,加入氯化钠检验银离子的存在,确认黑色固体为Ag的实验方案是:将黑色固体过滤、洗涤,向其中加入稀HNO3,黑色固体溶解并产生无色气体,遇空气后变成红棕色,并向所得溶液中滴加NaCl溶液,生成白色沉淀,
故答案为:将黑色固体过滤、洗涤,向其中加入稀HNO3,黑色固体溶解并产生无色气体,遇空气后变成红棕色,并向所得溶液中滴加NaCl溶液,生成白色沉淀;
(2)①2.0 mol/L NH4Cl溶液和镁反应,反应开始时产生H2的原因可能是Mg和NH4+直接反应,或反应开始时产生大量气体(经检验其中含有H2),铵根离子水解显酸性,NH4+水解使溶液中c(H+)增大,与Mg反应生成H2,
故答案为:NH4+水解使溶液中c(H+)增大,与Mg反应生成H2;
②一段时间后产生使湿润的红色石蕊试纸变蓝的气体为氨气,“一段时间后”产生的气体一定含有H2和NH3,
故答案为:NH3;
③向装有相同镁条的试管中加入2mL1.0mol/L (NH4)2SO4溶液,产生气体的速率明显慢于实验II,SO42-不利于Mg和铵盐溶液反应产生H2 ,结合实验II、IV,可以得出的结论是:Cl-有利于Mg和铵盐溶液反应产生H2(或SO42-不利于Mg和铵盐溶液反应产生H2、溶液中阴离子的种类会影响Mg和铵盐溶液反应产生H2,
故答案为:Cl-有利于Mg和铵盐溶液反应产生H2(或SO42-不利于Mg和铵盐溶液反应产生H2、溶液中阴离子的种类会影响Mg和铵盐溶液反应产生H2;
(3)②推测在pH=8.2的该溶液中,若无HCO3-,则H+和Mg反应的程度很小,验证此现象可以选取PH=8的氢氧化钠溶液检验是否和镁反应,其实验操作是:向装有相同镁条的试管中加入2mLpH=8.2的NaOH溶液,
故答案为:向装有相同镁条的试管中加入2mLpH=8.2的NaOH溶液;
(4)影响Mg与盐溶液反应多样性的原因是盐溶液中阳离子的氧化性、含Mg生成物的溶解性、盐溶液中阴离子的影响,故选ACD,
故答案为:ACD.
点评 本题考查了物质性质的实验验证、反应现象分析、实验对比方案设计、结论总结等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  | 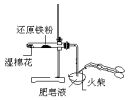 | 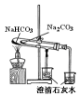 |
| 验证:溶解性AgCl>AgBr>Ag2S | 验证:非金属性Cl>C>Si | 验证:铁粉与水蒸气反应产生的氢气 | 验证:热稳定性 Na2CO3>NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
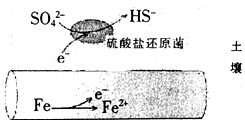 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )| A. | 正极反应为:SO42-+5H2O+8e-=HS-+9OH- | |
| B. | 输送暖气的管道不易发生此类腐蚀 | |
| C. | 这种情况下,Fe腐蚀的最终产物为Fe2O3•xH2O | |
| D. | 管道上刷富锌油漆可以延缓管道的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓氨水检验泄露的氯气,产生白烟:2NH3+3Cl2═6HCl+N2 | |
| B. | 铁氰化钾检验溶液中Fe2+,产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| C. | 浓溴水检验水体中的苯酚,产生白色沉淀: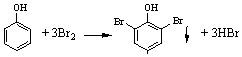 | |
| D. | 新制Cu(OH)2检验产品中乙醛,产生砖红色沉淀:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将C2H4和SO2的混合气体通入足量酸性KmnO4试液中 | 得到纯净的C2H4 |
| B | 向5mL 0.1mol•L-1AgNO3溶液中加1mL0.1mol•L-1NH3•H2O | 制备银氨溶液 |
| C | 向含少量FeBr2的FeCl2溶液中滴入适量新制氯水,并加入CCl4萃取分液 | 制备纯净的FeCl2溶液 |
| D | 向NaCl饱和溶液中先通入NH3至饱和,再通入足量CO2,过滤并洗涤 | 制备NaHCO3固体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ①常温下,配制0.10moI/L NaHCO3溶液,测其pH为8.4; ②取少量该溶液于试管中,向其中滴加CaCl2溶液至中性,滴加过程中只产生一种白色沉淀(能与盐酸作用产生气体),但无气体放出. |
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的水解 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)═c(HCO3-)+2c(CO32-)+c(Cl-)、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com