
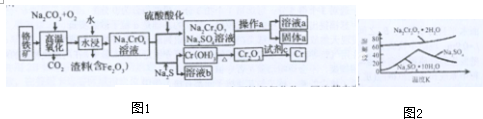
分析 工业上常用铬铁矿(主要成分为Fe(CrO2)2)为原料冶炼金属铬还可获得强氧化剂Na2Cr2O3流程:铬铁矿加入碳酸钠和氧气高温氧化生成Na2CrO4,二氧化碳和氧化铁,水浸过滤得到渣料氧化铁和滤液Na2CrO4溶液,溶液中加入稀硫酸酸化生成重铬酸钠和硫酸钠溶液,通过蒸发浓缩冷却结晶,依据溶解度图象分析可知,过滤得到固体a的主要成分是Na2SO4•10H2O,溶液a为重铬酸钾溶液,另一份Na2CrO4溶液中加入Na2S发生氧化还原反应,硫元素全部以S2O32-的形式存在.铬元素生成氢氧化铬沉淀,过滤后灼烧得到氧化铬,利用铝热反应制备金属铬;
(1)根据在化合物中正负化合价代数和为零,结合铬酸钠(Na2Cr2O3)的化学式进行解答,Cr(OH)3为两性氢氧化物,酸式电离出CrO2-和H+,碱式电离出铬离子和氢氧根离子;
(2)酸化过程中,不选用盐酸的原因是氯离子具有还原性易被氧化为氯气;
(3)与溶解度图象分析,得到硫酸钠晶体的方法是利用重铬酸钠溶解度随温度变化不大,硫酸钠溶解度速温度变化大,可以利用蒸发浓缩,冷却结晶,过滤得到晶体;
(4)加入Na2S溶液反应后,和Na2CrO4溶液反应生成氢氧化铬,硫元素全部以S2O32-的形式存在,依据原子守恒书写离子方程式;
(5)化合价升高的物质为还原剂、化合价降低的为氧化剂,铬铁矿加入碳酸钠和氧气高温氧化,该反应中O元素化合价由0价变为-2价、Fe元素化合价由+2价变为+3价,Cr元素化合价由+3价变为+6价,根据得失电子相等配平方程式分析;
(6)铝的还原性强于铬,氧化铬和铝高温反应生成铬和氧化铝;
解答 解:铬铁矿(主要成分是Fe(CrO2)2)为原料冶炼铬及获得强氧化剂Na2Cr2O3流程:铬铁矿加入碳酸钠和氧气高温氧化时,Fe(CrO2)2和碳酸钠、氧气反应氧化还原反应化学方程式为4Fe(CrO2)2+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2,生成Na2CrO4,二氧化碳和氧化铁,水浸过滤得到渣料氧化铁和滤液Na2CrO4溶液,溶液中加入稀硫酸酸化生成重铬酸钠和硫酸钠溶液,通过蒸发浓缩冷却结晶,依据溶解度图象分析可知,过滤得到固体a的主要成分是Na2SO4•10H2O,溶液a为重铬酸钾溶液,另一份Na2CrO4溶液中加入Na2S发生氧化还原反应8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH,硫元素全部以S2O32-的形式存在.铬元素生成氢氧化铬沉淀,过滤后灼烧得到氧化铬,利用铝热反应制备金属铬2Al+Cr2O3$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3 ;
(1)钠元素显+1价,氧元素显-2价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x+(-2)×3=0,则x=+2,Cr(OH)3的电离方程式为CrO2-+H++H2O?Cr(OH)3?Cr3++3OH-,
故答案为:+2;H++H2O+CrO2-?Cr(OH)3?Cr3++3OH-;
(2)铬酸根有强氧化性,氯离子具有还原性,酸化过程中,不选用盐酸的原因是氯离子易被氧化为氯气,
故答案为:铬酸根有强氧化性,把盐酸中的氯离子氧化,生成氯气;
(3)结合溶解度图象分析,溶液中得到硫酸钠晶体的方法是:利用重铬酸钠溶解度随温度变化不大,硫酸钠溶解度速温度变化大,可以利用蒸发浓缩,冷却结晶,过滤得到晶体,
故答案为:蒸发浓缩;冷却结晶;
(4)加入Na2S溶液反应后,和Na2CrO4溶液反应生成氢氧化铬,硫元素全部以S2O32-的形式存在,依据原子守恒书写离子方程式为,6S2-+8CrO42-+23H2O=3S2O32-+8Cr(OH)3+22OH-,
故答案为:6S2-+8CrO42-+23H2O=3S2O32-+8Cr(OH)3↓+22OH-;
(5)铬铁矿加入碳酸钠和氧气高温氧化时,O元素化合价由0价变为-2价、Fe元素化合价由+2价变为+3价,Cr元素化合价由+3价变为+6价,Fe(CrO2)2和碳酸钠、氧气反应氧化还原反应化学方程式为4Fe(CrO2)2+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2,反应中氧化剂与还原剂的物质的量之比为7:4,
故答案为:7:4;
(6)氧化铬和铝高温反应生成铬和氧化铝,反应的化学方程式为:2Al+Cr2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr,
故答案为:2Al+Cr2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
点评 本题考查了物质分离提纯的方法和过程分析判断,主要是物质溶解性、氧化还原反应产物的分析应用,离子方程式书写方法等,掌握分析流程的方法和基础知识是关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 50mL 盐酸 | 50mL 盐酸 | 50mL 盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为5.0mol•L-1 | |
| B. | 根据表中数据计算出混合物中NaHCO3的质量分数:0.457 | |
| C. | 加入固体混合物中NaHCO3和KHCO3的质量比为1:1 | |
| D. | 加入15.7g混合物时盐酸足量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高强度、质量轻 | B. | 耐热、抗高温 | C. | 耐腐蚀、稳定性好 | D. | 导电、导热性好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 预防H7N9流感病毒的措施之一是高温消毒餐具等生活日用品 | |
| B. | 大气中直径小于或等于2.5微米的颗粒物(PM2.5)会造成空气污染,应加强监测和治理 | |
| C. | 我国京津冀等城市实施SO2、CO2、NO2、N2等大气污染物排放限制 | |
| D. | 积极推广太阳能、风能、地热能等新能源的使用,减少化石燃料的使用,有效降低PM2.5对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| B. | 主族元素的原子核外电子最后填入的能级是s能级或p能级 | |
| C. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| D. | 向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的氢氧化铜沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com