
分析 (1)①水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英,所以原料中均有石灰石;
②橡胶有天然的和人工合成的,都是高分子材料;
③A.外面包上一层塑料层可减少与空气的接触;
B.在自行车钢圈上镀上一层金属铬可以隔绝空气;
C.原电池的负极发生氧化反应,能加快化学反应速率.
(2)①蛋白质水解生成氨基酸;蛋白质溶液中加入饱和硫酸铵会发生盐析;
②HClO具有强氧化性能使蛋白质变性;
③部分抗生素会产生不良反应要做皮试;
(3)①人体内的供能物质包括:糖类、油脂、蛋白质;
②维生素C成为抗坏血酸;
(4)处方药与非处方药的标志是R与OTC.
解答 解:(1)①生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;
生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石,
故答案为:石灰石(或CaCO3);
②橡胶分为天然橡胶和合成橡胶,天然橡胶的成分是聚异戊二烯 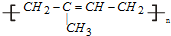 ,合成橡胶主要指:顺丁橡胶、氯丁橡胶、丁苯橡胶等,都为有机高分子材料,
,合成橡胶主要指:顺丁橡胶、氯丁橡胶、丁苯橡胶等,都为有机高分子材料,
故答案为:C;
③A.外面包上一层塑料层可减少与空气中氧气的接触,故A正确;
B.镀上一层金属铬可以隔绝空气,使内层金属不受腐蚀,故B正确;
C.原电池能加快化学反应速率,铁铜海水构成原电池,铁做负极加快铁的腐蚀,故C错误;
故答案为:C.
(2)①人体内蛋白质在蛋白酶作用下会发生水解反应生成氨基酸;蛋白质溶液中加入饱和硫酸铵会发生盐析,则在蛋清溶液中加入饱和硫酸铵溶液有沉淀析出的过程称为盐析,
故答案为:氨基酸;盐析;
②液氯注入水中后会生成HClO,HClO具有强氧化性能使蛋白质变性,所以能杀死水中细菌,
故答案为:HClO;
③部分抗生素会产生不良反应要做皮试,所以使用青霉素前使用者一定要进行皮肤敏感试验,
故答案为:皮试.
(3)①人体内的供能物质包括:糖类、油脂、蛋白质,因此油脂是重要的体内能源,故答案为:油脂;
②维生素C广泛存在于新鲜水果和绿色蔬菜中,又称为抗坏血酸,故答案为:维生素C;
(4)非处方药的标志是OTC,故答案为:B.
点评 本题考查知识点较多,注重化学与生活的联系,涉及材料、营养素以及药物等,利用化学知识来解决生活中的问题即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
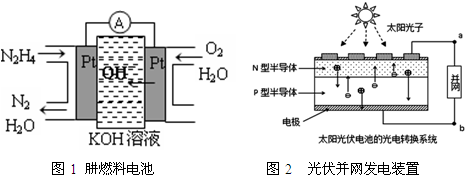
| A. | 氢氧燃料电池、太阳光伏电池中都利用了原电池原理 | |
| B. | 图1左边电极上发生的电极反应式为:N2H4-4e-+4OH-=N2+4H2O | |
| C. | 图2中N型半导体为正极,P型半导体为负极 | |
| D. | LED中的Ga和Y不可能都显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | La(NO3)3水溶液显酸性 | |
| B. | LaCl3的水溶液加热蒸发灼烧,最终得到无水LaCl3 | |
| C. | La和盐酸反应的离子方程式为:La+2H+=La3++H2↑ | |
| D. | 镧有两种核素:57139La和放射性57138La,由此可知镧元素的相对原子质量为138.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的单质不存在同素异形体 | |
| B. | 单质D着火时,可用二氧化碳灭火器灭火 | |
| C. | 化合物A2B2与C2B2均只有氧化性 | |
| D. | A、B、C组成的化合物,25℃时若溶液浓度为0.1mol/L,则由水电离出的OH-为10-13mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜、锰及其合金是人类常用的金属材料.
铜、锰及其合金是人类常用的金属材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NA个H2O | B. | 常温常压下,48g O2 | ||
| C. | 标准状况下,22.4L H2 | D. | 0.5mol CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4和SO2的反应速率可通过分光光度计用比色法测出不同反应时刻的浓度来计算. | |
| B. | 蒸馏时可用多种方法控制温度,用水浴加热分离碘并回收苯时,实验结束后,碘留在蒸馏烧瓶中. | |
| C. | 金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠保存在煤油中,白磷则可保存在水中. | |
| D. | 工业上电解饱和和盐水时,从安全性和综合效率角度考虑,往往用阴离子交换膜把阳极和阴极隔开 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com