
| A. | 加入盐酸以除去硫酸钠中少量的碳酸钠杂质 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快反应速率 | |
| C. | 用稀硫酸和锌反应制氢气时加入少许硫酸铜以加快反应速率 | |
| D. | 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |
分析 A.除杂时不能引进新的杂质;
B.过滤时不能用玻璃棒搅拌;
C.原电池能加快反应速率;
D.容量瓶只能配制一定物质的量浓度溶液,不能稀释或溶解药品.
解答 解:A.盐酸和碳酸钠反应生成氯化钠,引进新的杂质,应该用稀硫酸除去硫酸钠中的少量碳酸钠,故A错误;
B.过滤时不能用玻璃棒搅拌,否则易损坏滤纸,故B错误;
C.Zn能置换出Cu,Zn、Cu和稀硫酸构成原电池,加快化学反应速率,故C正确;
D.容量瓶只能配制一定物质的量浓度溶液,不能稀释或溶解药品,应该将浓硫酸在烧杯中稀释,然后冷却至室温后再转移到容量瓶中,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及除杂、基本操作、化学反应速率影响因素、溶液配制等知识点,明确实验原理及基本操作是解本题关键,注意操作的规范性及仪器用途,注意除杂时要除去杂质且不能引进新的杂质,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | 6.4g | B. | 9.6g | C. | 11.2g | D. | 12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,原因是二者可以发生双水解反应 | |
| B. | 电解精炼铜时,若阴极得到1.204×1024个电子,则阳极质量减少6.4g | |
| C. | 使甲基橙变红色溶液:Mg2+、K+、SO42-、NO3-能大量共存 | |
| D. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2-+O2+4H+=2S+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
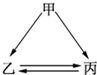 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )| A. | ①②③⑤ | B. | ②③④⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的KNO3溶液:H+、Fe2+、SO42- | |
| B. | 强碱性溶液:Na+、HCO3-、NO3-、SO42- | |
| C. | 遇酚酞变红的溶液中:K+、Na+、NH4+、Br- | |
| D. | 强酸性溶液:Na+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁中含有碳,抗腐蚀能力比纯铁强 | |
| B. | 钢铁发生析氢腐蚀时,负极反应是:Fe-3e-═Fe3+ | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| D. | 铁管上镶嵌锌块,铁管不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | CO2的水溶液:c(H+)>c(HCO3-)═2c(CO32-) | |
| C. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com