
分析 (1)根据工业流程可知,将③中MnO2回收,再发生①中的反应,可以提高MnO2利用率;
(2)K2MnO4在酸性条件下全转变为MnO2和KMnO4,同时生成水,根据电子转移守恒、电荷守恒、原子守恒配平;
(3)①根据n=cV计算的物质的量,再根据m=nM计算Na2S2O3的质量;
②发生反应:8MnO4-+5S2O32-+14H+=10SO42-+8Mn2++7H2O,结合方程式计算.
解答 解:(1)根据工业流程可知,将③中MnO2回收,再发生①中的反应,可以提高MnO2利用率,
故选:将③中MnO2回收,再发生①中的反应;
(2)滤液酸化后,K2MnO4转变为MnO2和KMnO4,则反应离子方程式为3MnO42-+4H+═MnO2↓+2MnO4-+2H2O,
故答案为:3MnO42-+4H+═MnO2↓+2MnO4-+2H2O;
(3)①n(Na2S2O3)=0.100mol•L-1×0.25L=0.025mol,
m(Na2S2O3)=0.025mol×158g/mol=3.950g,
故答案为:3.950;
②由反应方程式:8MnO4-+5S2O32-+14H+=10SO42-+8Mn2++7H2O,设样品中KMnO4物质的量为nmol,
可知 8KMnO4 ~5S2O32-
n 0.100 mol•L-1×12.00 mL×10-3 L
所以n(KMnO4)=$\frac{8}{5}$×0.100 mol•L-1×12.00 mL×10-3 L=1.92×10-3mol
所以m(KMnO4)=nM=1.92×10-3mol×158g/mol=0.30336g
KMnO4产品的纯度为:$\frac{0.30336g}{0.316g}$×100%=96%;
答:该KMnO4产品的纯度为96%.
点评 本题考查化学反应方程式的书写及有关氧化还原反应的计算,明确反应物与生成物及物质之间的关系是解答的关键,难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
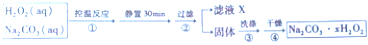
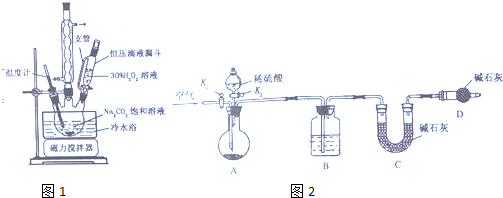
查看答案和解析>>
科目:高中化学 来源: 题型:选择题



| A. | ①②③④⑤ | B. | ②④⑥ | C. | ③⑤⑥ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丁烯 | B. | 1,3-二甲苯 | ||
| C. | 甲苯 | D. | 2-甲基-3-乙基-2-戊烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com