
【题目】通过FeCl3 溶液蒸干制得固体_________,原因是_____________________;继续灼烧产物是_____________ ,原因是 __________________________(离子方程式和文字说明)。
【答案】Fe(OH)3 Fe3+发生水解![]() ,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3 Fe2O3 灼烧发生
,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3 Fe2O3 灼烧发生![]() ,使Fe(OH)3分解生成Fe2O3
,使Fe(OH)3分解生成Fe2O3
【解析】
根据题中FeCl3 溶液蒸干可知,本题考查盐类水解,运用弱电解质水解分析。
在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3:![]() ,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼烧发生
,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼烧发生![]() ,使Fe(OH)3分解生成Fe2O3,故答案为:Fe(OH)3; Fe3+发生水解
,使Fe(OH)3分解生成Fe2O3,故答案为:Fe(OH)3; Fe3+发生水解![]() ,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3;Fe2O3;灼烧发生
,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3;Fe2O3;灼烧发生![]() ,使Fe(OH)3分解生成Fe2O3。
,使Fe(OH)3分解生成Fe2O3。


科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:

已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分铜”时各元素的浸出率如下表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_______。
(2)“分金”时,单质金发生反应的离子方程式为________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。

“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为_______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度(假定溶液中Ag+浓度为0.1mol/L)。________。
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
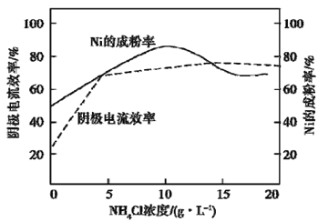
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3;②NaHCO3;③HCl;④NH3·H2O。
(1)上述溶液中,可发生水解的是________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的离子方程式分别为________________, ___________
(3)向溶液④中加入少量氯化铵固体,此时![]() 的值________(填增大、减小、不变)。
的值________(填增大、减小、不变)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积___④的体积(填大于、小于、等于)
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)内因:___________________。
(2)外因:①浓度:_________________________
②温度:________________________________________
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显__________,原因是_____________________________。多元弱酸酸式盐溶液的酸碱性取决于_____________________________________,例如NaHCO3溶液显碱性,原因是_________________,_______________________________(离子方程式和文字说明);
NaHSO3溶液显酸性的原因是________________,_____________________(离子方程式和文字说明)。
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O![]() CH3COOH+OH-_______________
CH3COOH+OH-_______________
改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
加入CH3COONa | ||||
通入HCl | ||||
升温 | ||||
加水 | ||||
加NaOH | ||||
加HAc | ||||
加NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵态氮肥和草木灰混合会降低肥效的原因是____________________,CH3COO-- 和NH4+、CO32--和NH4+在溶液中都是相互__________(促进或者抑制)的双水解,但是水解程度不大,可以大量共存。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④冰中存在极性共价键和氢键两种化学键的作用
⑤Cu(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中
⑥氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式为![]()
A. ①③⑥ B. ①②⑤ C. ③⑤⑥ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
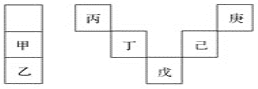
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究原电池和电解池的工作原理,某研究性学习小组分别用如图所示的装置进行实验,回答下列问题。
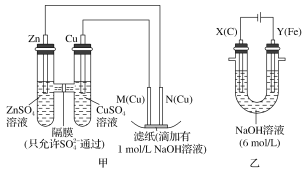
Ⅰ.用甲装置进行第一组实验:
(1)Zn电极上的电极反应式为___________________,在保证电极反应不变的情况下,下列材料不能代替左侧Cu电极(虚线方框内)的是________(填序号)。
A.石墨 B.镁 C.银 D.铂
(2)实验过程中,SO42-________(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有______________________________________
Ⅱ.该小组同学用乙装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根离子(FeO![]() )在溶液中呈紫红色。根据实验现象及所查信息,填写下列空白:
)在溶液中呈紫红色。根据实验现象及所查信息,填写下列空白:
(3)电解过程中,X极溶液的pH________(填“增大”、“减小”或“不变”)。
(4)电解过程中,Y极发生的电极反应为4OH--4e-===2H2O+O2↑和______________。
(5)已知K2FeO4和Zn可以构成碱性电池,其中K2FeO4在电池中作正极材料,电池总反应为2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2,则该电池正极发生的电极反应为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com