
不能作为判断硫、氯两种元素非金属性强弱的依据是 ( )
A. 单质氧化性的强弱 B. 氢化物沸点的高低
C. 氢化物还原性强弱 D. 最高价氧化物对应的水化物酸性的强弱
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.沸水中滴入FeCl3饱和溶液:Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
B.一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑
C.用氢氧化钠溶液吸收过量二氧化碳 OH—+CO2=HCO3—
D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ +2I- =2Fe2+ + I2
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与过量的很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
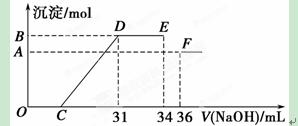
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
;
上述现象说明溶液中 结合OH-的能力比________强(填离子符号)。
(3)B与A的差值为________mol。
(4)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积
为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
某复合材料以碳纤维为增强体、金属钛为基体复合而成的。估计这种材料 ( )
①耐高温 ②不耐热 ③导电、导热 ④不导电、不导热
⑤可用于飞机机翼 ⑥可用于导弹的壳体
A.①③⑤⑥ B.②③⑤⑥ C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.同一主族相邻两个周期的元素的原子序数差一定等于上一周期所含元素种类
B.114号元素可能为非金属元素
C.L层上的电子数为奇数的元素一定是主族元素
D.目前使用的长式元素周期表中,最长的周期含36种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质的变化规律,与共价键键能大小有关的是 ( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅 ④NaF、NaCl、NaBr、NaI的熔点依次降低
A. 仅③ B.①③ C. ②③ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
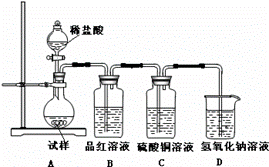
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量, 在滴加稀盐酸的整个过程中HSO3—的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl—外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原 因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中出现的异常情况,其可能原因分析错误的是( )
| 选项 | 异常情况 | 可能原因分析 |
| A | 蒸发结晶:蒸发皿破裂 | 将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
| B | 分液:分液漏斗中的液体难以滴下 | 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C | 蒸馏:冷凝管破裂 | 冷凝管没有通水或先加热后通水 |
| D | 萃取:液体静置不分层 | 加入萃取剂的量较多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com