
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:| △c |
| △t |
| n |
| v |
| △c(z) |
| △t |
| ||
| 2min |
| 0.3mol |
| 1.0mol |
| n |
| v |
| 0.9mol |
| 2L |


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
| hv |
| hv |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )
某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )| A、通入空气的电极为阳极 |
| B、甲装置中Fe电极的反应为Fe-3e-═Fe3+ |
| C、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为CO2 |
| D、当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为8.96 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加少量NaOH溶液,促进CH3COOH的电离,溶液的pH降低 |
| B、当V=20mL,溶液中存在:c(Na+)-c(CH2COO)+c(CH3COOH) |
| C、当V=20mL,NaOH与CH3COOH恰好反应时,所得溶液pH=7 |
| D、当0<V<20mL时,溶液中一定存在:c(Na+)>c(CH2COO)>c(OH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
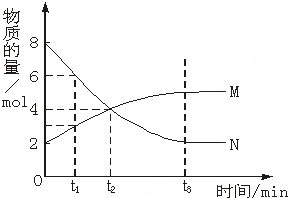
| A、反应的化学方程式为:M?N |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t1时,N的浓度是M浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4<H2O<HF<SiH4 |
| B、SiH4<CH4<H2O<HF |
| C、SiH4<HF<CH4<H2O |
| D、H2O<CH4<HF<SiH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com