
| y |
| 4 |
| y |
| 2 |
| y |
| 2 |
| y |
| 4 |
| y |
| 2 |
| y |
| 2 |
| y |
| 2 |
| 1 |
| 2 |
| 0.2625g |
| 0.00125mol |


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解 |
| B、所有的蛋白质都能溶于水 |
| C、浓硝酸溅在皮肤上能使皮肤呈现黄色,是由于浓硝酸和蛋白质发生了颜色反应 |
| D、向鸡蛋清中加入食盐,会使蛋白质凝固变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
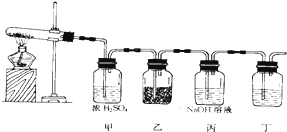
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O |
| 溶解 |
| 过量氯化钡溶液 |
| 过滤 |
| 水 |
| 洗涤 |
| 低温烘干、冷却、称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
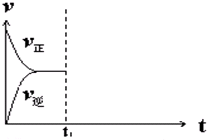 800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g)?H2(g)+CO2(g),反应过程中测定的部分数据见下表:
800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g)?H2(g)+CO2(g),反应过程中测定的部分数据见下表:| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | 0.80 | |
| n(H2O)/mol | 0.60 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
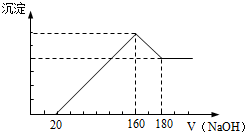 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com