
| A、①③⑤ | B、②③⑤ |
| C、②③⑥ | D、②④⑥ |


科目:高中化学 来源: 题型:
| A、①②③④ | B、①②③ |
| C、①③ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、限制化学工业发展,关停所有化工企业,消除污染源头 |
| B、积极推广太阳能、风能等新能源的使用,减少化石燃料的使用 |
| C、加强城市生活污水脱氮除磷处理,遏制水体富营养化 |
| D、禁止农村燃烧秸杆,积极推广沼气、秸秆发电、秸秆制乙醇等实用技术的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L |
| B、0.5 mol/L |
| C、0.15 mol/L |
| D、0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图①装置蒸发稀盐酸制浓盐酸 |
| B、用图②装置分液时,下层液体从分液漏斗下口放出,关闭活塞再将上层液体从上口倒出 |
| C、用图③洗涤沉淀时,漏斗中加入适量蒸馏水,搅拌并滤干 |
| D、用图④装置,分离四氯化碳与苯的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | H2C2O4溶液 | KMnO4溶液 | 硫酸溶液 | 温度/℃ | ||
| 浓度 (mol/L) | 体积 (mL) | 浓度 (mol/L) | 体积 (mL) | |||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、6 | D、9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
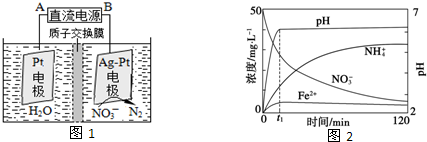
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com