
| A.仅由非金属元素组成的化合物一定是共价化合物 |
| B.普通陶瓷、玻璃、水泥是使用量最大的无机材料,其生产都采用含硅元素的原料 |
| C.同一温度下,向饱和AgCl溶液中加入盐酸,AgCl的KSP变大 |
| D.某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶了较多的CO2 |
科目:高中化学 来源: 题型:
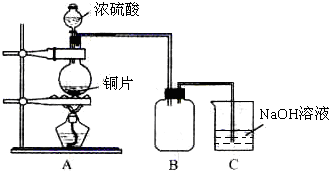
 某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:
某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
据现场一位围观的群众讲,早上10时多,石溪水域内突然冒起一股白烟,从漂在水面上的一个铁桶内窜出亮红色的火苗,紧接着一声巨响,蘑菇状的水柱冲天而起。“没想到水里的东西也能着火爆炸”,一位妇女惊讶地说。随后,直到中午,这个铁桶又连续爆炸了多次。爆炸腾起的白色烟雾约
正大公司的一名保安说,①飘进公司的白烟内还有许多没有燃烧的残渣,这些灰白色的物体一遇到水就不停地冒泡,有时甚至还会突然着火,为了防止引起火灾,公司的人只好在烟尘降落地喷了许多水,以便引燃这些仍然没有燃烧的东西。一位保安笑着说:“平常我们都是用水灭火,今天却要用水引火。”
据悉,早在前日,珠江水面上就发现了两只铁桶,其中一只在车陂附近的江面上爆炸了,另外一只则在石溪水面被路过的船只发现。据说,晚上6时45分左右,该船曾经将铁桶打捞上船,本打算清洗后使用。但是,当②船员把盖子打开后,桶内马上冒起浓浓的白烟,而且一旦③接触了桶内物质,双手立刻感到剧烈的疼痛,于是他们又将桶推到江里。④一遇到水,这个桶就爆炸了。
请完成下列问题:
(1)写出①中提到的“灰白色的物体”遇水反应的主要化学方程式。
(2)请你根据相关化学反应原理,解释③中描述的现象产生的原因。万一不小心用手直接触摸金属钠,应该怎样处理?
(3)根据相关化学反应原理,解释④中描述的现象产生的原因。如果保存金属钠的仓库失火,应该用什么样的方法灭火?
(4)据文章报道,“金属钠‘水雷’”有三只未发生爆炸,已被有关部门成功打捞。如果你是现场工作人员,你能否用所学化学知识分析,这三只桶打捞上船后应采取什么应急处理措施?
查看答案和解析>>
科目:高中化学 来源:2012届福建省四地六校高二下学期第一次月考化学试卷 题型:填空题
(12分) 图表法、图象法是常用的科学研究方法。请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

① 将Na—Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图像。从上图分析可知,同一主族元素原子的第一电离能I1变化规律是;__________________
_________________________________________________________________________
②上图折线中数字5代表元素在周期表中的位置是___________________________;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
Na |
O |
P |
S |
Si |
|
|
X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
②某有机化合物分子中含有S—N键,你认为该共用电子对偏向于____________原子(填元素符号)。
(3) 已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: _______________________________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
图表法、图象法是常用的科学研究方法。请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

① 将Na—Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图像。从上图分析可知,同一主族元素原子的第一电离能I1变化规律是;__________________
__________________________________________________________________________
②上图折线中数字5代表元素在周期表中的位置是___________________________;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是
____________________(填离子键或共价键)。
②某有机化合物分子中含有S—N键,你认为该共用电子对偏向于____________原子(填元素符号)。
(3) 已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:
________________________________________________________________________。
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
(4)有机反应如CH3—CH3 → CH2=CH2 + H2;有关化学键的键能如下:
化学键 C-H C=C C-C H-H
键能(kJ/mol) a b c d 该反应的ΔH ______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com