
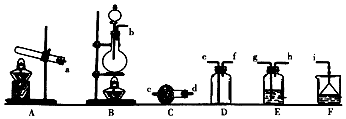
分析 (1)依据图中发生装置特点结合常见气体制备原理及反应条件解答;
(2)装置气密性的检查原理就是封闭式的物体在内壁受压的情况下,是否有漏气现象,据此分析解答;
(3)实验室用加热二氧化锰与浓盐酸方法制取氯气,氯气的氯气中含有氯化氢、水蒸气,依次通过盛有饱和食盐水、浓硫酸洗气瓶除去氯化氢和水蒸气,氯气密度大于空气密度,用向上排气法收集,应长进短出,最后用氢氧化钠溶液吸收过量的氯气,据此排序;
氯气具有强氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝,所以可以用湿润的淀粉碘化钾试纸检验;
(4)某实验小组按顺序连接adcfeg制取并收集氨气,氨气极易溶于水会引起倒吸;
解答 解:(1)图中A装置为制取固体与固体加热制备气体,实验室用加热高锰酸钾固体制备氧气,用加热固体氯化铵、氢氧化钙混合物制取氨气,二者都可以用A装置制取;
故答案为:氧气、氨气;
(2)装置B的气密性方法是:b端接上橡皮管,夹上止水夹;向分液漏斗加入水,打开活塞,若漏斗与圆底烧瓶保持稳定的液面差,证明气密性良好,否则漏气,
故答案为:b端接上橡皮管,夹上止水夹;向分液漏斗加入水,打开活塞,若漏斗与圆底烧瓶保持稳定的液面差,证明气密性良好,否则漏气;
(3)实验室用加热二氧化锰与浓盐酸方法制取氯气,氯气的氯气中含有氯化氢、水蒸气,依次通过盛有饱和食盐水、浓硫酸洗气瓶除去氯化氢和水蒸气,氯气密度大于空气密度,用向上排气法收集,应长进短出,最后用氢氧化钠溶液吸收过量的氯气,所以正确的连接顺序为:bghghefi;
氯气具有强氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝,所以可以用湿润的淀粉碘化钾试纸检验,用湿润的淀粉碘化钾试纸靠近导管口,若淀粉碘化钾试纸变蓝,则证明氯气存在;
故答案为:bghghefi;用湿润的淀粉碘化钾试纸靠近导管口,若淀粉碘化钾试纸变蓝,则证明氯气存在;
(4)(4)某实验小组按顺序连接adcfeg制取并收集氨气,导致实验失败,原因是:由于氨气极易溶于水,E装置的水倒吸入D中,导致实验失败,
故答案为:由于氨气极易溶于水,E装置的水倒吸入D中,导致实验失败.
点评 本题为实验题,考查了气体制备装置的选择,明确物质的状态、反应条件是选择发生装置依据,熟悉氯气的制备原理和性质即可解答,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ•mol-1 | 351 | 463 | 393 | 293 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 闭合K1,断开K2,可防止Fe发生吸氧腐蚀 | |
| B. | 闭合K1,断开K2,Cl-向石墨电极移动 | |
| C. | 闭合K2,断开K1,可用于制备家用消毒液(主要成分NaClO) | |
| D. | 闭合K2,断开K1,电解质溶液中Na+的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
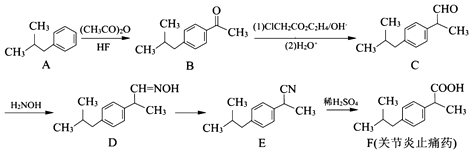
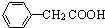 (任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有3种.
(任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有3种.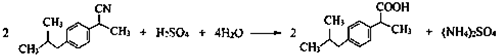 .
.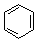 $→_{AlCl_{3}}^{RCl}$
$→_{AlCl_{3}}^{RCl}$
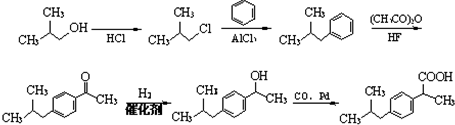
 $\stackrel{CO、Pd}{→}$
$\stackrel{CO、Pd}{→}$ R、R′表示烃基
R、R′表示烃基 、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
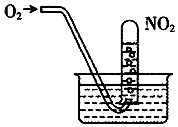
| A. | 当试管内溶液的pH值不再变化,说明NO2全部转化为HNO3 | |
| B. | 当试管气体不是红棕色时,说明NO2全部转化为HNO3 | |
| C. | 水槽内的水改为稀盐酸,有利于吸收NO2 | |
| D. | 水槽内的水改为稀NaOH溶液,有利于吸收NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和C12都能用于漂白 | B. | 苯酚、乙烯都能跟溴水反应 | ||
| C. | 苏打、小苏打水溶液的pH都大于7 | D. | I2,NH4Cl晶体受热都逐渐消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2+HCl Cu(OH)2+CH3COOH | |
| B. | NaHCO3+H2SO4 Na2CO3+HCl | |
| C. | NaHCO3+NaOH Ca(HCO3)2+NaOH | |
| D. | BaCl2+H2SO4 Ba(NO3)2+H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
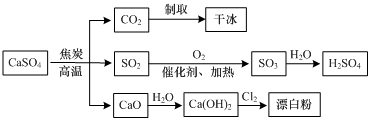
| A. | CO2制取干冰的过程吸收热量,属于物理变化 | |
| B. | 硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2 | |
| C. | 由SO2制取H2SO4的过程均为氧化还原反应 | |
| D. | 石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com