
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
 NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,[H2]=0.5 mol·L-1,[HI]=4 mol·L-1,则此温度下反应①的平衡常数为( )
A.9 mol2·L-2 B.16 mol2·L-2 C.20 mol2·L-2 D.25 mol2·L-2
科目:高中化学 来源: 题型:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请完成下列空白:
(1)铝元素在周期表中的位置为________。
(2)在19世纪时,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金 相当。1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是_________。
现代工业炼铝的原料是由铝土矿提取而得,在提取过程中通入的气体为____。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高 温下煅烧,所得物质可作耐高温材料,
 则反应过程中,每转移1 mol电子放出的热量为________。
则反应过程中,每转移1 mol电子放出的热量为________。
(4)硅与铝同周期,地壳里硅铝的含量:硅________铝(填>,<或=)。是硅酸盐玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成 。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
(5)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
 利用化学平衡移动原理解释上述方法可制取金属Ba的原因是
利用化学平衡移动原理解释上述方法可制取金属Ba的原因是
_____________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( )
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-===CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在可逆反应中,平衡常数与反应进行的限度的关系正确的是( )
A.K越大,反应程度越大
B.K越大,反应程度越小
C.K的大小与反应程度无关
D.升高温度,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)
 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)
 2H2O(g),
2H2O(g),
K=2×1081 mol-1·L;
③2CO2(g)
 2CO(g)+O2(g),K=4×10-92 mol·L-1
2CO(g)+O2(g),K=4×10-92 mol·L-1
则常温下,NO、H2O、CO2这三种化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是 ( )。
| I1 | I2 | I3 | I4 | …… | |
| R | 740 | 1 500 | 7 700 | 10 500 |
①R的最高正价为+3价 ②R元素位于元素周期表中第ⅡA族 ③R元素第一电离能大于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s2
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
把图2中的物质补充到图1中,可得到一个完整的氧化还原型离子方程式(未配平):
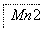 ……
……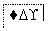
图1
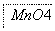
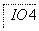
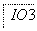
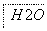

图2
对于该离子方程式的说法不正确的是 ( )。
A.IO 作氧化剂
作氧化剂
B.氧化性:Mn2+>IO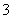
C.氧化剂与还原剂的物质的量之比为5∶2
D.若有2 mol Mn2+参加反应时,则转移10 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com