
【题目】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为___。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为___。(已知H2CO3 的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应的化学方程式为___。
(4)COS的水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
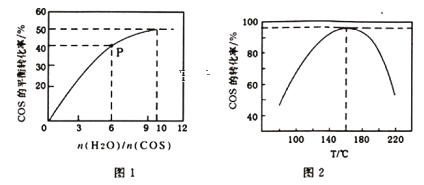
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]=___,温度___。
②P点对应的平衡常数为___。(保留小数点后2位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是___。
【答案】2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-632kJ·mol-1 1.0×103 COS+4H2O2=CO2↑+H2SO4+3H2O 10:1 160℃ 0.05 催化剂活性降低,反应速率变慢;该反应正反应为放热反应,升高温度平衡向逆反应方向移动
【解析】
(1)应用盖斯定律,(①![]() 2+②)
2+②)![]() 3得,2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=[(-362kJ/mol)
3得,2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=[(-362kJ/mol)![]() 2+(-1172kJ/mol)]
2+(-1172kJ/mol)]![]() 3=-632kJ/mol;
3=-632kJ/mol;
(2)反应K2CO3+H2S=KHS+KHCO3的离子方程式为CO32-+H2S=HS-+HCO3-,该反应的平衡常数K= 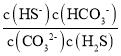 =
= 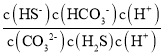 =
=![]() ;
;
(3)在强酸溶液中H2O2将COS氧化为H2SO4,同时生成CO2,H2O2被还原,该反应的化学方程式为4H2O2+COS=H2SO4+CO2↑+3H2O;
(4)①根据图1,随着![]() 的增大,COS的平衡转化率增大,当
的增大,COS的平衡转化率增大,当![]()
![]() 10:1,COS的平衡转化率增大不明显,反应的投料比最佳为
10:1,COS的平衡转化率增大不明显,反应的投料比最佳为![]() =10:1;根据图2,一定时间内COS的水解转化率在160℃时最大,反应的最佳温度为160℃;
=10:1;根据图2,一定时间内COS的水解转化率在160℃时最大,反应的最佳温度为160℃;
②P点![]() =6,平衡时COS的转化率为40%,设起始c(COS)=amol/L,则起始c(H2O)=6amol/L,用三段式可以求得;
=6,平衡时COS的转化率为40%,设起始c(COS)=amol/L,则起始c(H2O)=6amol/L,用三段式可以求得;
③当温度升高到一定值后,发现一定时间内COS的水解转化率降低,可能原因是:催化剂活性降低,反应速率变慢;该反应正反应为放热反应,升高温度平衡向逆反应方向移动。
(1)应用盖斯定律,(①![]() 2+②)
2+②)![]() 3得,2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=[(-362kJ/mol)
3得,2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=[(-362kJ/mol)![]() 2+(-1172kJ/mol)]
2+(-1172kJ/mol)]![]() 3=-632kJ/mol,H2S气体和氧气反应生成固态硫和液态水的热化学方程式为:2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=-632kJ/mol;
3=-632kJ/mol,H2S气体和氧气反应生成固态硫和液态水的热化学方程式为:2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=-632kJ/mol;
(2)反应K2CO3+H2S=KHS+KHCO3的离子方程式为CO32-+H2S=HS-+HCO3-,该反应的平衡常数K= 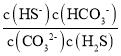 =
= 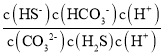 =
=![]() =
=![]() =1
=1![]() 103;
103;
(3)在强酸溶液中H2O2将COS氧化为H2SO4,同时生成CO2,H2O2被还原,该反应的化学方程式为4H2O2+COS=H2SO4+CO2↑+3H2O;
(4)①根据图1,随着![]() 的增大,COS的平衡转化率增大,当
的增大,COS的平衡转化率增大,当![]()
![]() 10:1,COS的平衡转化率增大不明显,反应的投料比最佳为
10:1,COS的平衡转化率增大不明显,反应的投料比最佳为![]() =10:1;根据图2,一定时间内COS的水解转化率在160℃时最大,反应的最佳温度为160℃;
=10:1;根据图2,一定时间内COS的水解转化率在160℃时最大,反应的最佳温度为160℃;
②P点![]() =6,平衡时COS的转化率为40%,设起始c(COS)=amol/L,则起始c(H2O)=6amol/L,用三段式
=6,平衡时COS的转化率为40%,设起始c(COS)=amol/L,则起始c(H2O)=6amol/L,用三段式
COS(g)+H2O(g)![]() CO2(g)+H2S(g)
CO2(g)+H2S(g)
c(起始)(mol/L) a 6a 0 0
c(转化)(mol/L)0.4a 0.4a 0.4a 0.4a
c(平衡)(mol/L)0.6a 5.6a 0.4a 0.4a
P点对应的平衡常数K= ![]() =
=![]() =0.05;
=0.05;
③当温度升高到一定值后,发现一定时间内COS的水解转化率降低,可能原因是:催化剂活性降低,反应速率变慢;该反应正反应为放热反应,升高温度平衡向逆反应方向移动。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式或说法正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJmol-1
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJmol-1
2NH3(g) ΔH=-38.6kJmol-1
C.同温同压下,反应H2+Cl2=2HCl在光照和点燃条件下分别发生反应,两者的反应热相同
D.已知中和热为57.3kJmol-1,则稀硫酸与氢氧化钡溶液反应的热化学方程式为2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,一定不能自发进行反应
B.已知:CH4(g)+![]() O2(g)=2H2O(l)+CO(g) ΔH,则ΔH表示CH4的燃烧热
O2(g)=2H2O(l)+CO(g) ΔH,则ΔH表示CH4的燃烧热
C.恒温恒压时,将2 mol A和1 mol B投入密闭容器中,发生反应:2A(g)+B(g)2C(g),充分反应后测得放出的热量为Q kJ,则该反应的ΔH=-Q kJ/mol
D.由4P(s,红磷)=P4(s,白磷) ΔH=+139.2 kJ/mol,可知红磷比白磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)碱性燃料电池的原理示意图如图所示,电池总反应为:N2H4+O2=N2+2H2O。下列说法错误的是( )
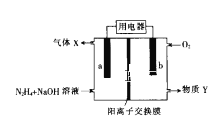
A.电极b发生氧化反应
B.电流由电极b流出经用电器流入电极a
C.物质Y是NaOH溶液
D.电极a的电极反应式为:N2H4+4OH--4e-=N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程都与热量变化有关,其中叙述正确的是
A.Ba(OH)2·8H2O与NH4Cl常温下混合就能反应,故该反应放热
B.已知2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol–1,故H2的燃烧热为241.8kJ·mol–1
C.已知H+-(aq)+OH-(aq)==H2O-(l)ΔH=-57.31kJ·mol–1,故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)=H2O(1)+BaSO4(s)ΔH<-57.31kJ·mol–1
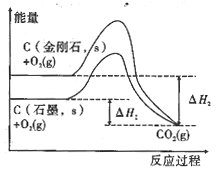
D.由图可知,反应C(金刚石,s)=C(石墨,s)的焓变ΔH=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的判断或表示方法正确的是
A.相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多
B.从C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知相同条件下金刚石比石墨更稳定
C.由H+(aq)+OH-(aq)= H2O(l) △H=-57.3 kJ·mol-1,可知:含1 molCH3COOH的稀溶液与含1 molNaOH的稀溶液混合,放出的热量大于57.3 kJ
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)= 2 H2O(l) △H=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
回答下列问题:
(1).上述反应中属于放热反应的是________。
(2).H2的燃烧热![]() ________________;C的燃烧热
________________;C的燃烧热![]() ________________。
________________。
(3).燃烧![]() 生成液态水,放出的热量为________。
生成液态水,放出的热量为________。
(4).写出CO燃烧的热化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,![]() 甲基
甲基![]() 中含有的中子数为
中含有的中子数为![]()
B.将![]() 溶于稀氨水中,所得溶液呈中性,则溶液中
溶于稀氨水中,所得溶液呈中性,则溶液中![]() 的数目为
的数目为![]()
C.![]() 和
和![]() 在催化剂和加热条件下充分反应生成NO的分子数为
在催化剂和加热条件下充分反应生成NO的分子数为![]()
D.常温下,![]() 的
的![]() 溶液中,发生电离的水分子数为
溶液中,发生电离的水分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH- –14e-→2CO![]() +12H2O、7H2O+7/2O2+14e-→14OH-,有关此电池的推断正确的是( )
+12H2O、7H2O+7/2O2+14e-→14OH-,有关此电池的推断正确的是( )
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中,CO![]() 向正极移动
向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com