
| A. | 氯化钙 | B. | 氢氧化钙 | C. | 氯化钠 | D. | 偏铝酸钠 |
科目:高中化学 来源: 题型:选择题
| A. | n=1 m=1 | B. | n=2 m=2 | C. | n=3 m=3 | D. | n=2 m=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L空气中含单质气体的分子数为NA | |
| B. | 1L0.5mol•L-1FeCl3溶液完全转化可制得0.5NA个Fe(OH)3胶体 | |
| C. | NA个N2分子所占的体积与0.5NA个H2分子所占的体枳比为2:1 | |
| D. | 2.3gNa完全与O2反应生成Na2O,失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{100({ρ}_{1}+{ρ}_{2})}$ | |
| B. | <“m“:math xmlns:dsi='http://www.dessci.com/uri/2003/MathML'dsi:zoomscale='150'dsi:_mathzoomed='1'style='CURSOR:pointer; DISPLAY:inline-block'>100(C1+C2)ρ3ρ1+ρ2$\frac{100({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ | |
| C. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{100({ρ}_{1}+{ρ}_{2})}$ | |
| D. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键 | |
| B. | [Cu(NH3)4]2+的空间构型为平面正方形,中心离子Cu2+采用sp3杂化 | |
| C. | [Cu(NH3)4]SO4会与乙醇发生反应生成深蓝色晶体 | |
| D. | [Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前已发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 元素周期表中共有18列,对应18个族 | |
| D. | 元素周期表中右上方区域的非金属元素多用于制造半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2、C2H4 | B. | C2H6、C2H8 | C. | C2H4、C4H8 | D. | CH4、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
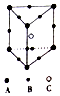
| A. | 3:9:4 | B. | 1:4:2 | C. | 6:9:1 | D. | 3:8:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com