
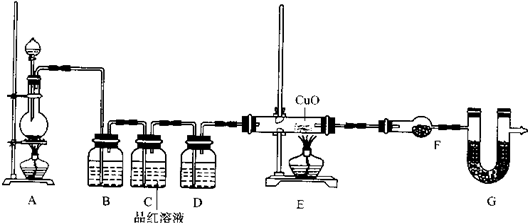
分析 根据题目给出的信息可知:随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2,因此化学小组所制得的气体中混有的主要杂质气体可能是氢气;A是制取气体的装置,B是吸收二氧化硫的装置,可以用氢氧化钠等碱液吸收;C是检验二氧化硫是否除尽的装置,D是浓硫酸,吸水干燥作用;E是用还原性气体还原氧化铜的装置,F中盛放的是无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验.
(1)随着硫酸浓度降低,锌与稀硫酸反应生成氢气;
(2)A是制取气体的装置,制备的气体中有二氧化硫、氢气、水蒸汽,B装置是除去二氧化硫,可以用氢氧化钠等碱液吸收;C装置是检验二氧化硫是否除尽,D装置是浓硫酸,吸水干燥作用;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验.
解答 解:(1)随着硫酸浓度降低,锌与稀硫酸反应生成氢气,所以化学小组所制得的气体中混有的主要杂质气体可能是氢气,
故答案为:H2;随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2:Zn+H2SO4═ZnSO4+H2↑,
(2)①B装置是除去二氧化硫,可以用氢氧化钠等碱液吸收,
故答案为:NaOH溶液;除去混合气体中的SO2;
②D装置是浓硫酸,吸水干燥作用,F装置无水硫酸铜,检验是否有水生成,
故答案为:浓硫酸;无水硫酸铜;
③E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成,只要黑色变红色,无水硫酸铜变蓝色,就证明是氢气,
故答案为:装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色;
④U型管G加入的试剂是碱石灰,防止空气中H2O进入干燥管而影响杂质气体的检验,
故答案为:碱石灰;防止空气中H2O进入干燥管而影响杂质气体的检验.
点评 本题是实验探究题,既有气体的制取又有气体的除杂和气体的吸收,还有气体的检验,综合性比较强,难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. | 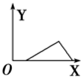 | D. | 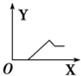 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液:CO32-+2H+═CO2↑+H2O | |
| B. | 用惰性电极电解饱和食盐水:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 饱和Ca(OH)2溶液中加入少量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 115号元素衰变成113号元素是化学变化 | |
| B. | 核素${\;}_{115}^{289}X$中中子数与质子数之差为174 | |
| C. | 113号元素最高正价应为+3 | |
| D. | 115号与113号元素的原子质量比为115:113 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(甲醛) | 水、浓硫酸 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| D | 淀粉胶体(氯化钠溶液) | 蒸馏水 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,密闭容器中发生反应:N2(g)+H2(g)?2NH3(g),NH3和H2的物质的量n随时间t变化的关系如图所示.图象中处于平衡状态的点是( )
一定条件下,密闭容器中发生反应:N2(g)+H2(g)?2NH3(g),NH3和H2的物质的量n随时间t变化的关系如图所示.图象中处于平衡状态的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com