
ÓŠA”¢B”¢C”¢DĖÄÖÖŌŖĖŲ£¬ĘäÖŠAŌŖĖŲŗĶBŌŖĖŲµÄŌ×Ó¶¼ÓŠ1øöĪ“³É¶Ōµē×Ó£¬A+ ±ČB﹣ÉŁŅ»øöµē×Ó²ć£¬BŌ×ÓµĆŅ»øöµē×ÓĢīČė3p¹ģµĄŗó£¬3p¹ģµĄŅŃ³äĀś£»CŌ×ÓµÄp¹ģµĄÖŠÓŠ3øöĪ“³É¶Ōµē×Ó£¬ĘäĘųĢ¬Ēā»ÆĪļŌŚĖ®ÖŠµÄČܽā¶ČŌŚĶ¬×åŌŖĖŲĖłŠĪ³ÉµÄĒā»ÆĪļÖŠ×ī“ó£»DµÄ×īøß»ÆŗĻ¼ŪŗĶ×īµĶ»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖ4£¬Ęä×īøß¼ŪŃõ»ÆĪļÖŠŗ¬DµÄÖŹĮæ·ÖŹżĪŖ40%£¬ĒŅĘäŗĖÄŚÖŹ×ÓŹżµČ×ÓÖŠ×ÓŹż£®RŹĒÓÉA”¢DĮ½ŌŖĖŲŠĪ³ÉµÄĄė×Ó»ÆŗĻĪļ£¬ĘäÖŠA+ÓėD2﹣Ąė×ÓŹżÖ®±ČĪŖ2£ŗ1£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©AŌŖĖŲŠĪ³ÉµÄ¾§ĢåÄŚ¾§°ūĄąŠĶÓ¦ŹōÓŚ””£ØĢīŠ“”°Įł·½”±”¢”°ĆęŠÄĮ¢·½”±»ņ”°ĢåŠÄĮ¢·½”±£©¶Ń»ż£¬æÕ¼äĄūÓĆĀŹĪŖ””””£®
£Ø2£©C3﹣µÄµē×ÓÅŲ¼Ź½ĪŖ””””£¬ŌŚCB3·Ö×ÓÖŠCŌŖĖŲŌ×ÓµÄŌ×Ó¹ģµĄ·¢ÉśµÄŹĒŌӻƣ¬CB3·Ö×ÓµÄVSEPRÄ£ŠĶĪŖ””””£®
£Ø3£©CµÄĒā»ÆĪļŌŚĖ®ÖŠµÄČܽā¶ČČēŗĪ””””
£Ø4£©DŌŖĖŲÓėĶ¬ÖÜĘŚĻąĮŚŌŖĖŲµÄµŚŅ»µēĄėÄÜÓɓ󵽊”µÄ¹ŲĻµŹĒ£ŗ£ØÓĆŌŖĖŲ·ūŗűķŹ¾£©£»ÓĆŅ»øö»Æѧ·½³ĢŹ½ĖµĆ÷B”¢DĮ½ŌŖĖŲŠĪ³ÉµÄµ„ÖŹµÄŃõ»ÆŠŌĒæČõ£ŗ””””
£Ø5£©ČēĶ¼ĖłŹ¾ŹĒRŠĪ³ÉµÄ¾§ĢåµÄ¾§°ū£¬øĆ¾§°ūÓėCaF2¾§°ū½į¹¹ĻąĖĘ£¬Éč¾§ĢåĆܶȏĒ ¦Ńg•cm﹣3£®ŹŌ¼ĘĖćR¾§ĢåÖŠA+ŗĶD2﹣×ī¶ĢµÄ¾ąĄė””””£®£Ø°¢·ü¼ÓµĀĀŽ³£ŹżÓĆNA±ķŹ¾£¬Ö»Š“³ö¼ĘĖćŹ½£¬²»ÓĆ¼ĘĖć£©
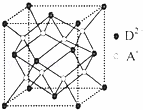
””
æ¼µć£ŗ
¾§°ūµÄ¼ĘĖć£»Ō×ÓŗĖĶāµē×ÓÅŲ¼£»ŌŖĖŲµēĄėÄÜ”¢µēøŗŠŌµÄŗ¬Ņå¼°Ó¦ÓĆ£»Ō×Ó¹ģµĄŌӻƷ½Ź½¼°ŌÓ»ÆĄąŠĶÅŠ¶Ļ£®
×ØĢā£ŗ
Ō×Ó×é³ÉÓė½į¹¹×ØĢā£»»Æѧ¼üÓė¾§Ģå½į¹¹£®
·ÖĪö£ŗ
BŌ×ÓµĆŅ»øöµē×ÓĢīČė3p¹ģµĄŗó£¬3p¹ģµĄŅŃ³äĀś£¬BĪŖClŌŖĖŲ£»B﹣Ąė×ÓĪŖCl﹣Ąė×Ó£¬A+±ČB﹣ÉŁŅ»øöµē×Ó²ć£¬A+ĪŖNa+Ąė×Ó£»CŌ×ÓµÄp¹ģµĄÖŠÓŠ3øöĪ“³É¶Ōµē×Ó£¬CŌ×ÓµÄĶāĪ§µē×ÓÅŲ¼ĪŖns2np3£¬ŹĒµŚ¢õA×åŌŖĖŲ£¬ĘäĘųĢ¬Ēā»ÆĪļŌŚĖ®ÖŠµÄČܽā¶ČŌŚĶ¬×åŌŖĖŲĖłŠĪ³ÉµÄĒā»ÆĪļÖŠ×ī“ó£¬ĖłŅŌĪŖNŌŖĖŲ£»DµÄ×īøß»ÆŗĻ¼ŪŗĶ×īµĶ»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖ4£¬ĪŖµŚ¢öA×åŌŖĖŲ£¬×īøß¼ŪŃõ»ÆĪļÖŠŗ¬DµÄÖŹĮæ·ÖŹżĪŖ 40%£¬æÉĶĘÖŖDµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ32£¬ĘäŗĖÄŚÖŹ×ÓŹżµČÓŚÖŠ×ÓŹż£¬ĖłŅŌÖŹ×ÓŹżĪŖ16£¬DĪŖSŌŖĖŲ£¬A+ŹĒNa+Ąė×Ó£¬D2﹣Ąė×ÓŹĒS2﹣Ąė×Ó£¬RŹĒÓÉNa+Ąė×ÓÓėS2﹣Ąė×ÓŅŌ2£ŗ1ŠĪ³ÉµÄĄė×Ó»ÆŗĻĪļ£¬RŹĒĮņ»ÆÄĘ£®
½ā“š£ŗ
½ā£ŗBŌ×ÓµĆŅ»øöµē×ÓĢīČė3p¹ģµĄŗó£¬3p¹ģµĄŅŃ³äĀś£¬BĪŖClŌŖĖŲ£»B﹣Ąė×ÓĪŖCl﹣Ąė×Ó£¬A+±ČB﹣ÉŁŅ»øöµē×Ó²ć£¬A+ĪŖNa+Ąė×Ó£»CŌ×ÓµÄp¹ģµĄÖŠÓŠ3øöĪ“³É¶Ōµē×Ó£¬CŌ×ÓµÄĶāĪ§µē×ÓÅŲ¼ĪŖns2np3£¬ŹĒµŚ¢õA×åŌŖĖŲ£¬ĘäĘųĢ¬Ēā»ÆĪļŌŚĖ®ÖŠµÄČܽā¶ČŌŚĶ¬×åŌŖĖŲĖłŠĪ³ÉµÄĒā»ÆĪļÖŠ×ī“ó£¬ĖłŅŌĪŖNŌŖĖŲ£»DµÄ×īøß»ÆŗĻ¼ŪŗĶ×īµĶ»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖ4£¬ĪŖµŚ¢öA×åŌŖĖŲ£¬×īøß¼ŪŃõ»ÆĪļÖŠŗ¬DµÄÖŹĮæ·ÖŹżĪŖ 40%£¬æÉĶĘÖŖDµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ32£¬ĘäŗĖÄŚÖŹ×ÓŹżµČÓŚÖŠ×ÓŹż£¬ĖłŅŌÖŹ×ÓŹżĪŖ16£¬DĪŖSŌŖĖŲ£¬A+ŹĒNa+Ąė×Ó£¬RŹĒÓÉNa+Ąė×ÓÓėD2﹣Ąė×ÓŅŌ2£ŗ1ŠĪ³ÉµÄĄė×Ó»ÆŗĻĪļ£¬D2﹣Ąė×ÓŹĒS2﹣Ąė×Ó£¬RŹĒĮņ»ÆÄĘ£®
£Ø1£©ÄĘŌŖĖŲŹōÓŚA2ĆܶѻżŹ½£¬øĆ¾§°ūŗ¬ÓŠ2øöŌ×Ó£¬ĖłŅŌNaŌŖĖŲŠĪ³ÉµÄ¾§ĢåÄŚ¾§°ūĄąŠĶÓ¦ŹōÓŚĢåŠÄĮ¢·½£¬ĘäæÕ¼äĄūÓĆĀŹĪŖ68%£¬
¹Ź“š°øĪŖ£ŗĢåŠÄĮ¢·½£»68%£»
£Ø2£©N3﹣ŗĖĶāÓŠ10øöµē×Ó£¬øł¾Ż¹¹ŌģŌĄķÖŖ£¬øĆĄė×Ó»łĢ¬ŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ£ŗls22s22p6£¬CB3·Ö×ÓĪŖNCl3·Ö×Ó£¬NŌ×ÓÓŠŅ»¶Ō¹Ā¶Ōµē×Ó£¬ÓėClŌ×Ó³É3øö¦Ä¼ü£¬ĖłŅŌCB3·Ö×ÓµÄVSEPRÄ£ŠĶĪŖĖÄĆęĢåŠĪ£¬
¹Ź“š°øĪŖ£ŗls22s22p6£»ĖÄĆęĢåŠĪ£»
£Ø3£©CµÄĒā»ÆĪļŹĒ°±Ęų£¬Ņ»Ģå»żĖ®ÄÜČܽā700Ģå»ż°±Ęų£¬°±Ęų·Ö×ÓŗĶĖ®·Ö×ÓÖ®¼äæÉŅŌŠĪ³ÉĒā¼ü£¬ĒŅ°±Ęų·Ö×ÓŗĶĖ®·Ö×Ó¶¼ŹĒ¼«ŠŌ·Ö×Ó£¬øł¾ŻĻąĖĘĻąČÜŌĄķÖŖ£¬°±Ęų¼«Ņ×ČÜÓŚĖ®£¬
¹Ź“š°øĪŖ£ŗ1£ŗ700ČÜÓŚĖ®»ņ¼«Ņ×ČÜÓŚĖ®£»°±·Ö×ÓŗĶĖ®·Ö×Ó¼äæÉŅŌŠĪ³ÉĒā¼ü£¬ĒŅ°±·Ö×ÓŗĶĖ®·Ö×Ó¾łĪŖ¼«ŠŌ·Ö×Ó£¬ĻąĖĘĻąČÜ£¬°±·Ö×ÓŗĶĖ®·Ö×Ó»¹æÉŅŌ·¢Éś·“Ó¦£¬°±Ęų¼«Ņ×ČÜÓŚĖ®£»
£Ø4£©Ķ¬Ņ»ÖÜĘŚŌŖĖŲÖŠ£¬ŌŖĖŲµÄµŚŅ»µēĄėÄÜĖę×ÅŌ×ÓŠņŹżµÄŌö“ó¶ų³ŹŌö“óĒ÷ŹĘ£¬µ«µŚVA×åŌŖĖŲµŚŅ»µēĄėÄÜ“óÓŚĻąĮŚŌŖĖŲ£¬ĖłŅŌP”¢S”¢ClŌŖĖŲµÄµŚŅ»µēĄėÄÜ“óŠ”Ė³ŠņŹĒ£ŗCl£¾P£¾S£»
Ķ¬Ņ»ÖÜĘŚŌŖĖŲÖŠ£¬ŌŖĖŲµÄµēøŗŠŌĖę×ÅŌ×ÓŠņŹżµÄŌö“ó¶ųŌö“ó£¬Ņ»°ćĄ“ĖµµēøŗŠŌŌ½Ē棬ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬¶ŌÓ¦µÄµ„ÖŹµÄŃõ»ÆŠŌŌ½Ē棬ČēŌŚH2S+Cl2=2HCl+S”ż·“Ó¦ÖŠ£¬Cl2µÄŃõ»ÆŠŌ“óÓŚO2µÄŃõ»ÆŠŌ£¬
¹Ź“š°øĪŖ£ŗCl£¾P£¾S£»H2S+Cl2=2HCl+S”ż£»
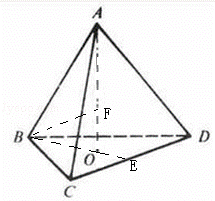
£Ø5£©øĆ¾§°ūÖŠÄĘĄė×ÓøöŹż=8£¬ŃõĄė×ÓøöŹż=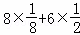 =4£¬¾§°ūµÄĢå»ż=
=4£¬¾§°ūµÄĢå»ż=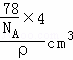 =
=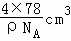 £¬¾§°ūµÄ±ß³¤=
£¬¾§°ūµÄ±ß³¤= cm£¬ĖÄøöŃõĄė×ÓŗĶŅ»øöÄĘĄė×Ó¹¹³ÉÕżĖÄĆęĢ壬ÄĘĄė×ÓĪ»ÓŚÕżĖÄĆęĢåµÄĢåŠÄÉĻ£¬
cm£¬ĖÄøöŃõĄė×ÓŗĶŅ»øöÄĘĄė×Ó¹¹³ÉÕżĖÄĆęĢ壬ÄĘĄė×ÓĪ»ÓŚÕżĖÄĆęĢåµÄĢåŠÄÉĻ£¬
ĖÄøöŃõŌ×ÓĪ»ÓŚÕżĖÄĆęĢåµÄ¶„µćÉĻ£¬ÄĘŌ×ÓĪ»ÓŚĢåŠÄÉĻ£¬ÕżĖÄĆęĢåµÄĄā³¤=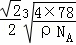 cm£¬
cm£¬
ÉčŃõĄė×ÓŗĶÄĘĄė×ӵľąĄėĪŖx£¬
ŌŚÕżČż½ĒŠĪBCDÖŠ£¬BEµÄ³¤=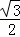
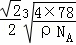 cm£¬BOŗĶOEµÄ³¤Ö®±ČĪŖ2£ŗ1£¬ĖłŅŌBOµÄ³¤=
cm£¬BOŗĶOEµÄ³¤Ö®±ČĪŖ2£ŗ1£¬ĖłŅŌBOµÄ³¤=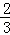
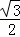
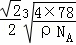 cm=
cm=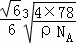 cm£¬£ØAOµÄ±ß³¤£©2=£Ø
cm£¬£ØAOµÄ±ß³¤£©2=£Ø £©2﹣£Ø
£©2﹣£Ø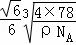 £©2£¬x2=£Ø
£©2£¬x2=£Ø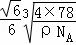 £©2+£ØAOµÄ±ß³¤﹣x£©2£¬ĖłŅŌx=
£©2+£ØAOµÄ±ß³¤﹣x£©2£¬ĖłŅŌx= cm£¬
cm£¬
¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ£ŗ
±¾Ģāæ¼²éĮĖĪļÖŹ½į¹¹ŗĶŠŌÖŹ£¬Éę¼°¾§°ūµÄ¼ĘĖć”¢ŌŖĖŲÖÜĘŚĀÉ”¢Ēā¼üµČÖŖŹ¶µć£¬ÕāŠ©¶¼ŹĒѧĻ°ÖŲµćŅ²ŹĒѧĻ°ÄŃµć£¬Ķ¬Ź±æ¼²éѧɜµÄæÕ¼äĻėĻóÄÜĮ¦¼°ŹżŃ§Ó¦ÓĆÄÜĮ¦£¬½įŗĻÕżČż½ĒŠĪµÄŠŌÖŹ·ÖĪö½ā“š£¬ÄŃ¶Č½Ļ“ó£®
””””


 ÓĄĒ¬½ĢÓżŗ®¼Ł×÷ŅµæģĄÖ¼ŁĘŚŃÓ±ßČĖĆń³ö°ęÉēĻµĮŠ“š°ø
ÓĄĒ¬½ĢÓżŗ®¼Ł×÷ŅµæģĄÖ¼ŁĘŚŃÓ±ßČĖĆń³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠÓŠ¹ŲĖµ·Ø“ķĪóµÄŹĒ£Ø£©
A£® Ķعż»Æѧ·“Ó¦ĪŽ·ØÉś³ÉŠĀµÄĶ¬Ī»ĖŲ
B£® Čō»ÆŃ§Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ŌņÕż·“Ó¦ĖŁĀŹŅ»¶ØŌö“ó
C£® ŃĪĖį”¢ĒāŃõ»ÆĢś½ŗĢ唢ĘūÓĶ”¢Ļš½ŗ¾łĪŖ»ģŗĻĪļ
D£® Éś³ÉŃĪ ŗĶĖ®µÄ·“Ó¦²»Ņ»¶ØŹĒÖŠŗĶ·“Ó¦
ŗĶĖ®µÄ·“Ó¦²»Ņ»¶ØŹĒÖŠŗĶ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
1molijӊ»śĪļ³ä·ÖČ¼ÉÕ£¬Ö»Éś³É88g¶žŃõ»ÆĢ¼ĘųĢåŗĶ54gĖ®£¬ĻĀĮŠÕżČ·µÄŹĒ£Ø””””£©
”” A£® øĆÓŠ»śĪļµÄ·Ö×ÓŹ½ĪŖCH4
”” B£® øĆÓŠ»śĪļµÄ·Ö×ÓŹ½Ņ»¶ØĪŖC2H6
”” C£® øĆÓŠ»śĪļµÄ·Ö×ÓŹ½Ņ»¶ØĪŖC2H6O
”” D£® øĆÓŠ»śĪļµÄ·Ö×ÓÖŠĢ¼Ō×ÓŗĶĒāŌ×ÓµÄøöŹż±ČĪŖ1£ŗ3£¬æÉÄÜŗ¬ÓŠŃõŌ×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ļą¶Ō·Ö×ÓÖŹĮæĪŖ100µÄĢžĶźČ«Č¼ÉÕŗó£¬Éś³ÉCO2ŗĶH2OµÄĪļÖŹµÄĮæÖ®±ČŅŌ¼°·Ö×Ó½į¹¹ÖŠÓŠĖÄøö¼×»łµÄĶ¬·ÖŅģ¹¹ĢåµÄŹżÄæ·Ö±šŹĒ£Ø””””£©
| ”” | A£® | 6£ŗ7ŗĶ2 | B£® | 6£ŗ7ŗĶ3 | C£® | 7£ŗ8ŗĶ3 | D£® | 7£ŗ8ŗĶ4 |
””
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
| ”” | A£® | ŅŅ“¼·Ö×ÓÖŠµÄĒāŌ×Ó¾łæɱ»½šŹōÄĘÖĆ»» |
| ”” | B£® | Ģž·Ö×ÓÖŠµÄĒāŌ×Ó±»ōĒ»łČ”“śŗóµÄŃÜÉśĪļ¶¼ŹōÓŚ“¼ |
| ”” | C£® | ¼×“¼ŹĒ×ī¼ņµ„µÄ“¼£¬Ėü²»ÄÜ·¢ÉśĻūČ„·“Ӧɜ³ÉĻ©Ģž |
| ”” | D£® | ijŅ»ŌŖ“¼ŌŚÅØĮņĖį“ęŌŚĻĀ¼ÓČȵ½170”ęæÉŅŌÉś³É±ūĻ©£¬øĆŅ»ŌŖ“¼Ņ»¶ØŹĒ1﹣±ū“¼ |
””
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŌĻĀĶéĢžÖŠ£¬Ņ»ĀČ“śĪļÖ»ÓŠŅ»ÖֵďĒ£Ø””””£©
”” A£® ŅŅĶé B£® ±ūĶé
”” C£® 2﹣¼×»ł¶”Ķé D£® 2£¬2﹣¶ž¼×»ł¶”Ķé
””
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
£®ĻĀĮŠø÷ÓŠ»śĪļŌŚ²»Ķ¬Ģõ¼žĻĀ£¬¼ČÄÜ·¢ÉśĖ®½ā·“Ó¦£¬ÓÖÄÜ·¢ÉśĻūČ„·“Ó¦£¬»¹ÄÜ·¢Éśõ„»Æ·“Ó¦µÄŹĒ£Ø””””£©
”” A£® 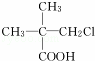 B£®
B£® 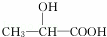 C£®
C£® 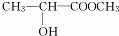 D£®
D£® 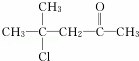
””
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½ńÓŠŅ»»ģŗĻĪļµÄĖ®ČÜŅŗ£¬Ö»æÉÄÜŗ¬ÓŠŅŌĻĀĄė×ÓÖŠµÄČōøÉÖÖ£ŗNa+”¢NH4+”¢Mg2+”¢Ba2+”¢CO32©”¢SO42©”¢Cl©£¬ĻÖȔȿ·Ż100mLČÜŅŗ½ųŠŠČēĻĀŹµŃé£ŗøł¾ŻÉĻŹöŹµŃ飬ŅŌĻĀĶĘ²āÕżČ·µÄŹĒ£Ø””””£©
£Ø1£©µŚŅ»·Ż¼ÓČėAgNO3ČÜŅŗÓŠ³Įµķ²śÉś
µŚ¶ž·Ż¼Ó×ćĮæKOHČÜŅŗ¼ÓČČŗó£¬ŹÕ¼Æµ½ĘųĢå0.08mol
£Ø3£©µŚČż·Ż¼Ó×ćĮæBaCl2ČÜŅŗŗ󣬵ĆøÉŌļ³Įµķ12.54g£¬¾×ćĮæŃĪĖįĻ“µÓ”¢øÉŌļŗ󣬳ĮµķÖŹĮæĪŖ4.66g£®
”” A£® Na+Ņ»¶Ø“ęŌŚ
”” B£® 100mLČÜŅŗÖŠŗ¬0.01mol CO32©
”” C£® Cl©Ņ»¶Ø“ęŌŚ
”” D£® Ba2+Ņ»¶Ø²»“ęŌŚ£¬Mg2+æÉÄÜ“ęŌŚ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ČēĶ¼ĖłŹ¾£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø£©
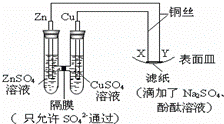
A£® YĪŖŅõ¼«£¬·¢Éś»¹Ō·“Ó¦ B£® XĪŖÕż¼«£¬·¢ÉśŃõ»Æ·“Ó¦
C£® YÓėĀĖÖ½½Ó“„“¦ÓŠŃõĘųÉś³É D£® XÓėĀĖÖ½½Ó“„“¦±äŗģ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com