
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2+8NH3 7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
(2)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=?196.6 kJ·mol–1
2SO3(g) ΔH=?196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=?113.0 kJ·mol–1
2NO2(g) ΔH=?113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则该反应的平衡常数K= 。
(3)汽车尾气中的一氧化碳可通过如下反应降低其浓度:CO(g)+1/2O2(g) CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
容器编号 | c(CO)/mol·L–1 | c(O2)/mol·L–1 | c(CO2)/mol·L–1 | υ(正)和υ(逆) 大小比较 |
① | 2.0×10–4 | 4.0×10–4 | 4.0×10–4 | υ(正)=υ(逆) |
② | 1.0×10–3 | 4.0×10–4 | 5.0×10–4 | υ(正) υ(逆) |
(1)6.72L(2分)
(2)①NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8kJ/mol(2分)②bd(2分)
SO3(g)+NO(g) △H=-41.8kJ/mol(2分)②bd(2分)
③ (2分) (3)>(2分)
(2分) (3)>(2分)
【解析】
试题分析:(1)根据方程式6NO2+8NH3 7N2+12H2O可知,NO2中氮元素的化合价从+4价降低到0价,得到4个电子,所以当转移1.2mol电子时,消耗的NO2的物质的量是1.2mol÷4=0.3mol,则在标准状况下的体积是0.3mol×22.4L/mol=6.72L。
7N2+12H2O可知,NO2中氮元素的化合价从+4价降低到0价,得到4个电子,所以当转移1.2mol电子时,消耗的NO2的物质的量是1.2mol÷4=0.3mol,则在标准状况下的体积是0.3mol×22.4L/mol=6.72L。
(2)①已知反应①2SO2(g)+O2(g) 2SO3(g) ΔH=?196.6 kJ·mol–1,②2NO(g)+O2(g)
2SO3(g) ΔH=?196.6 kJ·mol–1,②2NO(g)+O2(g) 2NO2(g) ΔH=?113.0 kJ·mol–1,则根据盖斯定律可知(①-②)÷2即得到反应NO2(g)+SO2(g)
2NO2(g) ΔH=?113.0 kJ·mol–1,则根据盖斯定律可知(①-②)÷2即得到反应NO2(g)+SO2(g) SO3(g)+NO(g),所以该反应的反应热△H=(?196.6 kJ/mol+113.0 kJ/mol)÷2=-41.8kJ/mol。
SO3(g)+NO(g),所以该反应的反应热△H=(?196.6 kJ/mol+113.0 kJ/mol)÷2=-41.8kJ/mol。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以解答。a、该反应前后体积不变,因此压强始终是不变的,即体系压强保持不变不能说明反应达到平衡状态,a不正确;b、颜色的深浅与物质的浓度有关系,所以混合气体颜色保持不变,说明NO2的浓度不再发生变化,因此反应达到平衡状态,b正确;C、SO3和NO是生成物,二者的体积比之比始终是1:1,所以SO3和NO的体积比保持不变不能说明反应达到平衡状态,c不正确;d、每消耗1 mol SO2的同时必然同时消耗1molNO2,而同时又生成1 molNO2,这说明正逆反应速率相等,反应达到平衡状态,d正确,答案选bd。
③ NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始量(mol) 1 2 0 0
转化量(mol) x x x x
平衡量(mol) 1-x 2-x x x
测得上述反应平衡时NO2与SO2体积比为1:6
则(1-x):( 2-x)=1:6
解得x=0.8
由于反应前后体积不变,所以可以用物质的量代替浓度表示平衡常数
该反应的平衡常数K= =
= =
= 。
。
(3)容器①中υ(正)=υ(逆),说明反应达到平衡状态,则该反应的平衡常数K= =100。根据容器②中物质的浓度可知,此时
=100。根据容器②中物质的浓度可知,此时 =25<100,所以反应向正反应方向进行,则υ(正)>υ(逆)。
=25<100,所以反应向正反应方向进行,则υ(正)>υ(逆)。
考点:考查氧化还原反应的计算、热化学方程式书写、平衡状态判断以及平衡常数计算与应用


科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:填空题
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。

(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)。
(5)10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量。
(6)能说明该反应已经达到平衡状态的是( )
a. v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.恒容容器内物质的密度保持不变
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是( )
a.及时分离出SO3气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是
A.水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),Na2CO3第一步水解反应的水解常数的表示式 Kh≤
B.HS-电离的离子方程式:HS-+H2O H3O++S2-
H3O++S2-
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小
D.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为:
CO(g)+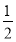 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下,把1 mL0.l mol/L的 H2SO4加水稀释制成2L溶液,在此溶液中由水电离产生的 H+浓度接近于
A.1.0×10─4 mol/L B.1.0×10─ 8 mol / L
C.1.0×10─10 mol/L D.1.0×10─11mol/L
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
未来新能源的特点是资源丰富、对环境污染小,且可以再生。下列属于未来新能源的是
①天然气 ②煤 ③氢能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能
A.①②③④ B.③⑤⑥⑦ C.④⑤⑥⑦ D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届湖北省三校高二上学期期末联考化学试卷(解析版) 题型:选择题
常温下,在c(H+)/c(OH?)=1×1012的溶液中,下列各组离子能大量共存的是
A.Fe2+、Mg2+、NO3?、SO42? B.Fe3+、Na+、Cl?、SCN?
C.NH4+、Al3+、NO3?、Cl? D.Ca2+、K+、Cl?、HCO3?
查看答案和解析>>
科目:高中化学 来源:2015届湖北省三校高二上学期期末联考化学试卷(解析版) 题型:选择题
为除去下列物质所含的杂质(括号内的物质),有关除杂试剂和操作合理的是
A.乙醇(水):加氢氧化钙固体,过滤
B.乙酸乙酯(乙酸):加氢氧化钠溶液,分液
C.溴水(溴化钠):除杂过程中涉及的操作有:加CCl4,萃取、分液
D.苯甲酸(苯甲酸钠):加稀硫酸,蒸馏
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是

A.反应①是加成反应 B.只有反应②是加聚反应
C.反应④⑤⑥⑦是取代反应 D.只有反应⑦是取代反应
查看答案和解析>>
科目:高中化学 来源:2015届浙江省慈溪市高二上学期期末测试化学试卷(解析版) 题型:选择题
下列有关金属腐蚀与防护的说法正确的是
A.纯银器表面在空气中会因化学腐蚀渐渐变暗
B.地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀
C.海轮外壳连接锌块是采用牺牲阴极的阳极保护法保护外壳不受腐蚀
D.当镀锡铁制品的镀层破损时,锡镀层仍能对铁制品起保护作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com