
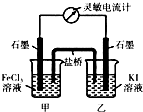
 如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题:
如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题:分析 (1)U形管中是电解水,b电极附近呈红色,说明b电极附近显碱性,氢离子在b电极放电,所以Y为负极,b为阴极;
(2)电解硫酸铜溶液时,阳极上会产生氧气,阴极上会产生金属铜;
(3)电解酚酞的水溶液后的溶液仍显中性.
解答 解:(1)通电电解酚酞的水溶液时,b极附近溶液呈红色,说明b连接的Y为电源的负极,则X为正极,故答案为:正;
(2)电解硫酸铜时,阳极上会产生氧气,阳极电极反应式为4OH--4e-=2H2O+O2↑,阴极上会产生金属铜,阴极电极反应式为2Cu2++4e-=2Cu,总反应为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,故答案为:阳极电极反应式为4OH--4e-=2H2O+O2↑,阴极电极反应式为2Cu2++4e-=2Cu;2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑;
(3)电解酚酞的水溶液,就是电解水,电解后溶液显中性,电解后的溶液倒入另一空烧杯中充分搅拌,溶液显无色,故答案为:无.
点评 本题考查电解池的工作原理知识,题目难度中等,注意根据电极现象判断电源的正负极为解答该题的关键.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH、CuSO4 | B. | NaOH、新制Cu(OH)2 | C. | Na2CO3、CuSO4 | D. | H2SO4、新制Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、氯乙烯都属于不饱和烃 | |
| B. | 油脂、葡萄糖都能发生水解反应 | |
| C. | 乙酸、乙酸乙酯都不能与金属Na反应 | |
| D. | 苯能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
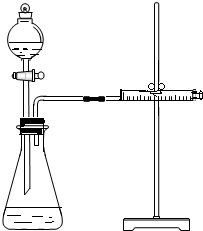 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②分别投入大小、形状相同的Cu、Fe、Mg | 反应速率Mg>Fe,Cu反应最慢 | 金属性质越活泼,反应 速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池在放电时,Ag电极是电池的负极 | |
| B. | 充电时阳极发生的电极反应是:2Ag+2OH--2e-═Ag2O+H2O | |
| C. | 该电池可用酸作电解质溶液 | |
| D. | 充电时电流从Zn电极经电解质溶液流向外接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
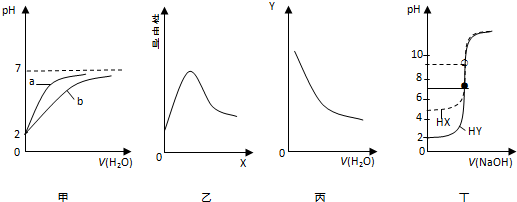
| A. | 图甲表示pH均为2的盐酸和醋酸分别用水稀释时pH变化曲线,其中a为醋酸 | |
| B. | 图乙表示0.1 mol•L-1 醋酸中加入X后溶液导电性曲线,则X可能是0.1 mol•L-1 氨水 | |
| C. | 图丙表示0.1 mol•L-1 氨水不断用水稀释曲线,Y可能是c(OH-) | |
| D. | 图丁表示0.0100 mol•L-1 NaOH溶液分别滴定20.00 mL 浓度均为0.0100 mol•L-1HX和HY的滴定曲线,可判断HX酸性比HY强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,若加入淀粉溶液,溶液显蓝色,则一定有I- | |
| B. | 取样,若加入AgNO3溶液由白色沉淀,则一定有Cl- | |
| C. | 取样,若加入BaCl2溶液,有白色沉淀产生,则一定有SO42- | |
| D. | 取样,若加入NaOH溶液,微热,产生使湿润红色石蕊试纸变蓝的气体,则一定有NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com