
【题目】下列指定反应的离子方程式正确的是
A.向NaAlO2溶液中滴入NaHCO3溶液:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
B.MnO2与浓盐酸混合加热:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+=Fe3++2H2O
D.Ca(HCO3)2溶液中加入过量氨水:Ca2++HCO3-+NH3·H2O=CaCO3↓+H2O+NH4+
【答案】A
【解析】
A.NaAlO2和NaHCO3发生反应生成氢氧化铝程度和碳酸钠,离子方程式为AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,故A正确;
B.MnO2与浓盐酸混合加热,离子方程式:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O,故B错误;
Mn2++Cl2↑+2H2O,故B错误;
C.电荷不守恒,FeSO4溶液中加入盐酸酸化的H2O2的离子方程式为2H++2Fe2++H2O2═2Fe3++2H2O,故C错误;
D.Ca(HCO3)2溶液中加入过量氨水,碳酸氢根离子完全反应,离子方程式:Ca2++2HCO3-+2NH3H2O=CaCO3↓+2H2O+2NH4++CO32-,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
(1)B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,___________;④____________________,___________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E_________,原因是__________。
(4)若184g B和120g D反应能生成106g E,则该反应的产率______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20 mL0.1 mol/L H2A溶液中逐滴加入0.1 mol/L NaOH溶液,H2A溶液中各粒子浓度分数δ(X)随溶液pH变化的关系如图所示。下列说法错误的是 ( )
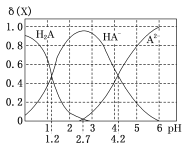
A.当溶液中A元素的主要存在形态为A2-时,溶液可能为弱酸性、中性或碱性
B.当加入NaOH溶液至20 mL时,溶液中存在((Na+)=2c(A2-)+c(HA-)
C.室温下,反应A2-+H2A=2HA-的平衡常数的对数值lgK=3
D.室温下,弱酸H2A的第一级电离平衡常数用Ka1表示,Na2A的第二级水解平衡常数用Kh2表示,则Kal>Kh2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法正确的是( )
A.已知K=![]() ,则对应的化学反应可以表示为:2CO2(g) + 6H2(g)
,则对应的化学反应可以表示为:2CO2(g) + 6H2(g)![]() CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
B.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小
C.常温下,向纯水中加入碳酸钠,水的电离程度变大,Kw变大
D.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型太阳光电化学电池贮能时电解质溶液中离子在两极发生如下图所示的转化。
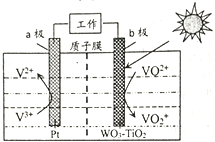
下列说法正确的是( )
A. 贮能时,电能转变为化学能和光能
B. 贮能和放电时,电子在导线中流向相同
C. 贮能时,氢离子由a极区迁移至b极区
D. 放电时,b极发生:VO2++2H++e-=VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___K。
II.将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___。
(2)反应前A的物质的量浓度是___。
(3)10s末,生成物D的浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为___(填代号)。
a.KMnO4b.(NH4) 2S c.H2O2d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、_________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是_____。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)__________(填化学式),若实验过程中有氨气逸出,应选用下列_____装置回收(填代号)。

(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应______________________,直到______________________________,用KMnO4标准溶液滴定时应选用___滴定管(填“酸式”或“碱式”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.因为反应物浓度越大,反应速率越快,所以常温下,相同的铝片中分别加入足量的浓硝酸、稀硝酸中,浓硝酸中铝片先溶解完
B.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
C.N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大
2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大
D.对于反应2H2O2===2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com