
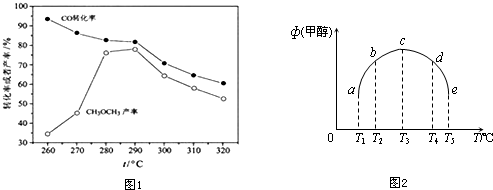
分析 (1)依据热化学方程式和盖斯定律进行计算,依据计算得到的反应结合化学平衡移动原理分析判断增大压强的影响;
(2)依据化学平衡移动原理分析;
(3)①平衡常数指的是:生成物浓度之幂或分压力的乘积与反应物浓度的幂或分压力的乘积之间的比值,根据平衡常数的定义列出表达式;
②根据影响化学反应速率和化学平衡的因素进行判断得出正确结论.a、b没有达到平衡状态,c、d、e达到平衡状态;
③根据影响化学平衡的因素进行判断得出正确结论.
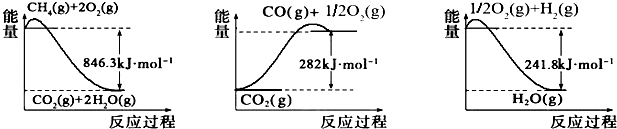
解答 解:(1)Ⅰ、CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ•mol-1
Ⅳ、2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ•mol-1
依据盖斯定律Ⅰ×2+Ⅳ得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g),△H=-204.7kJ•mol-1;
该反应是气体体积减小的反应,增加压强,平衡正向进行,反应速率加快,CO和H2的转化率增大,CH3OCH3产率增加,
故答案为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g),△H=-204.7kJ•mol-1;增大压强,化学反应速率增大,平衡正向移动,CO和H2转化率增大,CH3OCH3产率增加;
(2)CO转化率随温度升高而降低,是因为反应是放热反应,升温平衡逆向进行,故答案为:反应放热,温度升高,平衡逆向移动;
(3)①平衡常数指的是:生成物浓度之幂或分压力的乘积与反应物浓度的幂或分压力的乘积之间的比值,故KP=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;
②反应进行到t时刻时,a、b没有达到平衡状态,c、d、e达到平衡状态,故T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以甲醇的体积分数随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以甲醇的体积分数减少,
故答案为:T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以甲醇的体积分数随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以甲醇的体积分数减少;
③将容器c中的平衡状态转变到容器d中的平衡状态,即降低甲醇的含量,使平衡逆向移动,可采取的措施有:升温、减压,
故答案为:升温;降压.
点评 本题考查了热化学方程式和盖斯定律的应用,化学平衡移动原理的分析判断,平衡常数的表示方法,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏小 | |
| B. | 滴定实验时,锥形瓶用蒸馏水洗净后,直接盛待测液 | |
| C. | 用洁净的玻璃棒蘸取新制氯水,滴在pH 试纸上,然后与比色卡对照,可测定新制氯水的pH 值 | |
| D. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其的反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| B. | 分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4-二甲基戊烷或3,3-二甲基戊烷 | |
| C. | 完全燃烧等质量的甲醛、乙酸、葡萄糖、蔗糖消耗的氧气量相等 | |
| D. | 还原性染料靛蓝的结构简式为: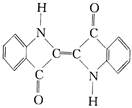 ,它的分子式是:C16H10N2O2 ,它的分子式是:C16H10N2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将20g硝酸钠和17g氯化钾放入100ml烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体 | |
| B. | 焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀硫酸洗净并灼烧 | |
| C. | 中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果 | |
| D. | 移液管取液后,将移液管垂直伸入容器里面,松开食指使溶液全部流出,数秒后,取出移液管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧的摩尔质量是48 g | |
| B. | 1mol臭氧的体积是22.4L | |
| C. | 16 g臭氧中含有6.02×1023个氧原子 | |
| D. | 已知每个氧原子内有8个质子,那么1 mol臭氧中含有3mol质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com