
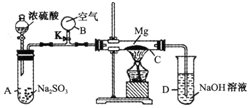
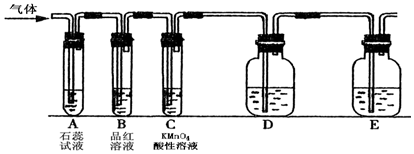
 按如图装置进行如下实验,请用你所学知识完成下题:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发生耀眼白光,产生白烟,管壁上附有淡黄色物质.实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.
按如图装置进行如下实验,请用你所学知识完成下题:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发生耀眼白光,产生白烟,管壁上附有淡黄色物质.实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.分析 浓硫酸和亚硫酸钠反应生成二氧化硫气体,Mg与SO2在加热的条件下能够发生化学反应生成淡黄色固体S,臭鸡蛋气味的气体为硫化氢,因此二氧化硫与Mg反应产物为MgS、S.根据元素守恒可知,另外一种产物为氧化镁,打开K,将空气充入反应反应体系,可平衡容器内外压强,防止倒吸,以此解答该题.
解答 解:(1)Mg与玻璃中的二氧化硅在高温下反应的化学方程式为2Mg+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Si,不能直接接触管壁的目的为Mg与玻璃中的SiO2反应腐蚀玻璃,
故答案为:加热条件下,Mg与玻璃中的SiO2反应腐蚀玻璃;
(2)停止实验后,温度降低导致体系内部压强减小,容易发生倒吸,打开K,将空气充入反应反应体系,可平衡容器内外压强,防止倒吸,
故答案为:防止C降温时因C中气体压强减小而引起D中溶液的倒吸;
(3)浓硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫与Mg反应,生成淡黄色固体S,臭鸡蛋气味的气体为硫化氢,因此二氧化硫与Mg反应产物为MgS.根据元素守恒可知,另外一种产物为MgO,
故答案为:MgO、MgS、S.
点评 本题考查了物质实验室制备原理和装置选择,为高频考点,侧重考查学生的分析能力和实验能力,注意把握实验步骤的设计分析判断,物质性质的应用是解题关键,题目难度中等.


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:填空题
 、
、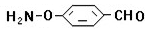 、
、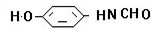 、
、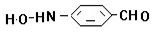 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolNa2O和Na2O2混合物中含有的阴阳离子总数大于3NA | |
| B. | 常温常压下,20gD2O分子中所含中子数为10NA | |
| C. | 50ml12mol•L-1的盐酸与足量的MnO2共热转移的电子数为0.3 NA | |
| D. | 密闭容器中2mol NO和Imol的O2,充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. (其中一种).
(其中一种). )的合成路线.
)的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是( )
将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是( )| A. | OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3- | |
| B. | A点溶液中的溶质为NaCl、NaHCO3 | |
| C. | 混合物中NaOH的质量0.60 g | |
| D. | 当加入35 mL盐酸时,产生CO2的体积为224 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com