
| ʱ��/min SO2����/10-3g �¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
���� ��1����֪����CaCO3��s��?CO2��g��+CaO��s����H=+178.2kJ/mol
��SO2��g��+CaO��s��?CaSO3��s����H=-402kJ/mol
��.2CaSO3��s��2+O2��s��+4H2O��l��?2[CaSO4•2H2O]��H=-234.2kJ/mol
���ݸ�˹���ɢ��2+���2+��ɵ�ʯ��ʯ����������������ˮ��Ӧ���ɵ�ʯ�Ҹ���Ȼ�ѧ��Ӧ����ʽ��
��2��a������ƽ����ƶ������ж�3��������SO2��ƽ��ת���ʵĴ�С˳��
b��A�����������ƽ��Ħ�������������������ʵ����ı�ֵ�����������״̬��ƽ��״̬��
c��A��B���������ﵽƽ�����õ�ʱ��ͷ�Ӧ�����йأ�
d��ƽ�ⳣ�����¶��йأ�ƽ�ⳣ�����䲻��ȷ����ƽ��״̬��
��3���ٸ���v=$\frac{��c}{��t}$���㣻
����ͬʱ����ڣ�����������ٵ�Խ�࣬˵����Ӧ����Խ�죬�¶ȸ߷�Ӧ���ʿ죻�÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����������ĺ�������
����T2�¶��£���ƽ����������ݻ�ѹ��Ϊ10L������ƽ��ʱSO2��Ũ�ȵ���ԭƽ��ʱSO2��Ũ�ȣ��¶Ȳ��䣬ƽ�ⳣ�����䣮
��� �⣺��1����֪����CaCO3��s��?CO2��g��+CaO��s����H=+178.2kJ/mol
��SO2��g��+CaO��s��?CaSO3��s����H=-402kJ/mol
��.2CaSO3��s��2+O2��s��+4H2O��l��?2[CaSO4•2H2O]��H=-234.2kJ/mol
���ݸ�˹���ɢ��2+���2+��ɵ�2CaCO3��s��+2SO2��g��+O2��g��+4H2O��l��=2[CaSO4•2H2O]��s��+2CO2��H=-681.8kJ/mol��
�ʴ�Ϊ��2CaCO3��s��+2SO2��g��+O2��g��+4H2O��l��=2[CaSO4•2H2O]��s��+2CO2��H=-681.8kJ/mol��
��2��a��A���������º�ѹ���÷�Ӧ��һ�����������С�ķ�Ӧ�����ŷ�Ӧ�������������С�������ŷ�Ӧ�������������С���൱������ѹǿ�����������ת��������B���������º��ݣ����ŷ�Ӧ�Ľ��У������������С�������A��ѹǿС�����������ת�������AҪС��C���������¾��ȣ��÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ������B���������ת���ʻ�С����a��ȷ��
b��A�����������������ʵ������ڷ����ı䣬ƽ��Ħ���������DZ����������ж�ƽ�⣬��b����
c��A����ѹǿ��B�ʷ�Ӧ���ʿ죬�ﵽƽ�������ʱ��A��B�̣���C����
d��ƽ�ⳣ��ֻ���¶ȵĺ������¶Ȳ��䣬ƽ�ⳣ�����䣬ƽ�⣬��d��ȷ��
�ʴ�Ϊ��ad��
��3������T1�¶��£�����20-40min��SO2�ķ�Ӧ����v��SO2��=$\frac{��1052-540����1{0}^{-3}g��64g/mol��20L}{20min}$=2��10-5mol/��L•min����
�ʴ�Ϊ��2��10-5��
�ڸ���ͼ������ͬʱ����ڣ�����������ٵ�Խ�࣬˵����Ӧ����Խ�죬�¶ȸ߷�Ӧ���ʿ죬��T1��T2���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����������ĺ����ϴ������ݵĵݱ���ɣ�x��0.06��
�ʴ�Ϊ����������
����T2�¶��£���ƽ����������ݻ�ѹ��Ϊ10L������ƽ��ʱSO2��Ũ�ȵ���ԭƽ��ʱSO2��Ũ�ȣ���Ϊ�÷�Ӧ��ƽ�ⳣ������ʽΪk=$\frac{1}{c��S{O}_{2}��}$���¶Ȳ��䣬ƽ�ⳣ�����䣬����Ũ����ȣ�
�ʴ�Ϊ��=���÷�Ӧ��ƽ�ⳣ������ʽΪk=$\frac{1}{c��S{O}_{2}��}$���¶Ȳ��䣬ƽ�ⳣ�����䣬����Ũ����ȣ�
���� ���⿼�黯ѧ��Ӧ�����ʡ���ѧƽ�ⳣ������ʽ����ѧƽ����ƶ��ͷ�Ӧ���Է��Եȣ���Ŀ�Ѷ��еȣ�ע�����֪ʶ�Ļ��ۣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Va��10Vb | B�� | Vb=10Va | C�� | Vb��10Va | D�� | Vb��10Va |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
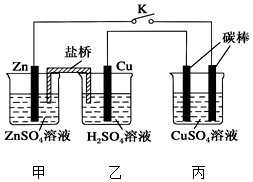 ����ͼ��ʾ��װ�ý���ʵ�飬��Ӧһ��ʱ���Ͽ�K������ձ��м���0.1mol CuO��CuSO4��Һǡ�ûָ�����Ӧǰ��Ũ�ȣ�����˵���в���ȷ���ǣ�������
����ͼ��ʾ��װ�ý���ʵ�飬��Ӧһ��ʱ���Ͽ�K������ձ��м���0.1mol CuO��CuSO4��Һǡ�ûָ�����Ӧǰ��Ũ�ȣ�����˵���в���ȷ���ǣ�������| A�� | ���ձ���ͭ��Ϊ��������缫��ӦʽΪ2H++2e-�TH2�� | |
| B�� | ���ձ��Ҳ�̼��Ϊ��������缫�����к�ɫ�������� | |
| C�� | ��Ӧʱ�����е�����������ձ��ƶ� | |
| D�� | ������ͨ�����ӵ����ʵ���Ϊ0.1 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
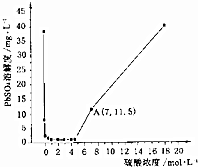 ��֪25��ʱKSP��PbSO4��=1.6��10-8��KSP��BaSO4��=1.1��10-10�����¶���PbSO4�ڲ�ͬŨ�ȵ������е��ܽ����ͼ��ʾ�������й�˵������ȷ���ǣ�������
��֪25��ʱKSP��PbSO4��=1.6��10-8��KSP��BaSO4��=1.1��10-10�����¶���PbSO4�ڲ�ͬŨ�ȵ������е��ܽ����ͼ��ʾ�������й�˵������ȷ���ǣ�������| A�� | ͼ��A��c��SO42-��=7mol•L-1 | |
| B�� | ���˵�PbSO4��������ϡ����ϴ�ӣ����Լ��ٳ������ | |
| C�� | ����Ũ�ȴ���5mol•L-1ʱ��PbSO4�ܽ�������ԭ����ת����Pb��HSO4��2 | |
| D�� | ��Pb��NO3��2��Ba��NO3��2�����Һ����ϡ�����У�������PbSO4��BaSO4���ֳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
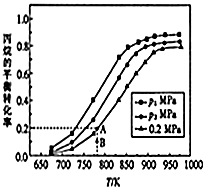 ��ϩ��C3H6��������۱�ϩ����ϩ��Ȼ�����Ʒ��ԭ�ϣ�Ŀǰ���ڿ������飨C3H8���ѽ���ȡ��ϩ����ԭ��ΪC3H8��g��?C3H6��g��+H2��g����H���ش��������⣺
��ϩ��C3H6��������۱�ϩ����ϩ��Ȼ�����Ʒ��ԭ�ϣ�Ŀǰ���ڿ������飨C3H8���ѽ���ȡ��ϩ����ԭ��ΪC3H8��g��?C3H6��g��+H2��g����H���ش��������⣺| ���ۼ� | C-C | C=C | C-H | H-H |
| ����/KJ•mol-1 | 348 | 615 | 413 | 436 |
| n��CO2��/n��C3H8���¶�/K | 600 | 700 | 800 | 900 | 1000 |
| 0��1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1��1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1��2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1��3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2��I-��Fe2+��Cl- | B�� | I-��Fe2+��Cl-��SO2 | C�� | Cl-��Fe2+��SO2��I- | D�� | Fe2+��I-��Cl-��SO2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com