
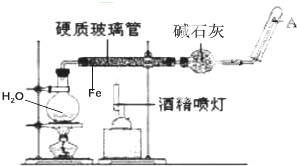
 如图是在高温下,Fe与水蒸气的反应实验.
如图是在高温下,Fe与水蒸气的反应实验.分析 由图可知,圆底烧瓶中加热提供水蒸气,在硬质玻璃管中发生Fe与水蒸气的反应生成四氧化三铁和氢气,用碱石灰干燥氢气,在A中收集生成的氢气;注意加热液体时要防止暴沸,点燃可燃性气体前要检验气体的纯度.以此来解答.
解答 解:(1)圆底烧瓶中加热提供水蒸气,在硬质玻璃管中发生Fe与水蒸气的反应生成四氧化三铁和氢气,发生氧化还原反应:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)圆底烧瓶中盛装的水,该装置在受热后的主要作用是:产生水蒸气;烧瓶底部放置了几片碎瓷片的目的是:防止暴沸;
故答案为:提供水蒸气;防止暴沸;
(3)圆底烧瓶中加热提供水蒸气,在硬质玻璃管中发生Fe与水蒸气的反应生成四氧化三铁和氢气,碱石灰用来干燥氢气,在A中收集纯净的氢气;
故答案为:干燥生成的氢气;
(4)水蒸气在硬质管中与铁粉反应生成的氢气,经碱石灰干燥后,在A中被收集;氢气的爆炸极限是4.0%~75.6%,即当氢气的含量在上述范围内时就会引起爆炸,因此,点燃氢气之前要检验纯度;点燃任何可燃性气体之前都要检验纯度,以防爆炸;
故答案为:氢气;验纯.
点评 本题考查性质实验的设计,涉及到实验基础知识,把握发生的反应及装置的作用、掌握实验安全知识为解答关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com