
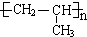 ;
; ;
; ;
;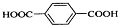 ),与(CH3CH2CH2OH)在浓硫酸作用下发生酯化反应生成
),与(CH3CH2CH2OH)在浓硫酸作用下发生酯化反应生成 .
.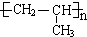 ,方程式为:
,方程式为: ,
, .
. ,
, ;
; ,故答案为:
,故答案为: ;
; ),与(CH3CH2CH2OH)在浓硫酸作用下发生酯化反应生成
),与(CH3CH2CH2OH)在浓硫酸作用下发生酯化反应生成 ,反应方程式为:
,反应方程式为: +2CH3CH2CH2OH
+2CH3CH2CH2OH| 浓硫酸 |
| △ |
 +2H2O,反应类型为:酯化反应,
+2H2O,反应类型为:酯化反应, +2CH3CH2CH2OH
+2CH3CH2CH2OH| 浓硫酸 |
| △ |
 +2H2O;酯化反应.
+2H2O;酯化反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、在25℃时,若溶液呈中性,则pH=7,AG=1 |
| B、在25℃时,若溶液呈酸性,则pH<7 AG<0 |
| C、在25℃时,若溶液呈碱性,则pH>7 AG>0 |
| D、在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 1.44 | 9.6 | 9.6 |
| 催化剂 |
| n(H2) |
| n(CO2) |
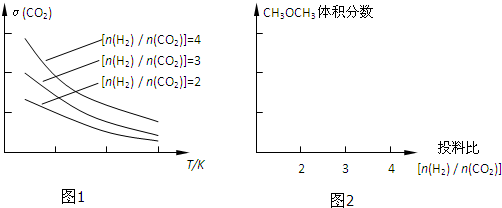
| n(H2) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验过程和现象 | 对应结论 | |
| 步骤1 | 取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 |  | |
| 步 骤 2 | 第①份 试液 |  | 碘盐中肯定含 |
| 第②份 试液 |  |  | |
| 第③份 试液 |  | X为 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠与水反应后的溶液滴加酚酞,液体会变为红色 |
| B、过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 |
| C、碳酸钠俗称大苏打,碳酸氢钠俗称苏打 |
| D、氧化铝是冶炼金属铝的重要原料,也是一种比较好的耐火材料,它可以用来制造耐火坩埚,耐火管和耐高温的实验仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
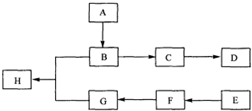
 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:| O2/Cu |
| △ |
| C |
| 一定条件 |
| (1)[Ag(NH3)2]OH,△ |
| (2)H+ |
| F |
| 浓H2SO4△ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:
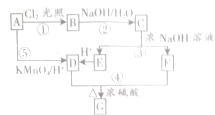
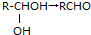 +H2O,其中C能发生银镜反应,并且C在浓碱条件下可以发生自身氧化还原反应生成E和F,且E、F分子中碳原子的数目相同.
+H2O,其中C能发生银镜反应,并且C在浓碱条件下可以发生自身氧化还原反应生成E和F,且E、F分子中碳原子的数目相同.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com