
分析 (1)化合价降低元素所在的反应物是氧化剂,该元素被还原,化合价升高元素所在的反应物是还原剂,该元素被氧化,根据化学方程式计算;
(2)电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等.
非电解质:在水溶液中或熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
存在自由移动离子的物质能导电.
解答 解:(1)在Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2的反应中,铁元素的化合价降低,所以铁元素被还原,Fe3O4是氧化剂,碳元素化合价升高,所以碳元素被氧化,CO是还原剂,当有4mol的CO气体完全反应时,生成Fe是3mol,故当有标状下的CO气体560ml即0.025molCO完全反应时,生成Fe是$\frac{0.025mol×3}{4}×56g/mol$=1.05g,
故答案为:CO;Fe;1.05;
(2)①⑤⑩中存在自由移动的粒子,这些物质能导电;②④⑨是在水溶液中或熔融状态下能导电的化合物,属于电解质;⑥⑦是在水溶液中或熔融状态下不能导电的化合物,属于非电解质,故答案为:①⑤⑩;②④⑨;⑥⑦.
点评 本题主要考查的是氧化还原反应中的基本概念、电解质与非电解质的概念,注意掌握电解质与非电解质均指的是化合物,难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体.为减少“雾霾”的发生,可采取以下措施:
近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体.为减少“雾霾”的发生,可采取以下措施:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力: CO32-<AlO2- |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度: Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
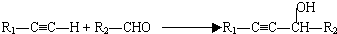 (R代表烃基,下同.)
(R代表烃基,下同.)
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Na+ AlO2- Cl- | B. | K+ Na+ Cl- CO32- | ||
| C. | Fe3+ Na+ Cl- HCO3- | D. | SO42- Fe2+ H+ NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
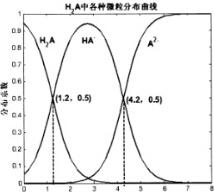 常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在0.1mo/LNaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量的NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有前四周期元素A、B、C、D、E,原子序数依次增大.A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍.基态B原子与A同周期,p能级达到半充满.C原子电子层数与最外层电子数相等.B和E同主族,基态D原子的价层电子排布通式为ns2np1.
现有前四周期元素A、B、C、D、E,原子序数依次增大.A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍.基态B原子与A同周期,p能级达到半充满.C原子电子层数与最外层电子数相等.B和E同主族,基态D原子的价层电子排布通式为ns2np1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com