
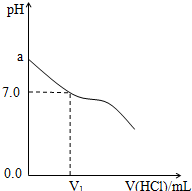
 常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的Ph值的变化关系如图所示.
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的Ph值的变化关系如图所示.分析 (1)a点为醋酸钠溶液,醋酸根离子部分水解,导致溶液显示碱性,溶液的pH大于7.0;
(2)溶液的pH=7,则c(OH-)=c(H+),然后结合物料守恒和电荷守恒分析;
(3)当加入盐酸的体积为20.0mL时,两种物质刚好完全反应,生成c(CH3COOH)=0.10mol/L,
CH3COO-+H2O?CH3COOH+OH-
起始时各物质浓度/mol•L-1 0.10 0 0
平衡时各物质浓度/mol•L-1 0.10-1.3×10-3≈0.10 1.3×10-3 1.3×10-3
然后结合Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$计算出CH3COH的电离平衡常数Ka.
解答 解:(1)a点没有加入盐酸,则此时为醋酸钠溶液,醋酸根离子存在水解平衡:CH3COO-+H2O?CH3COOH+OH-,导致溶液呈碱性,则a>7.0,
故答案为:CH3COO-+H2O?CH3COOH+OH-;
(2)根据电荷守恒有:c(OH-)+c(Cl-)+c(CH3COO-)=c(H+)+c(Na+) 由于溶液的pH=7,则c(OH-)=c(H+),所以①c(Cl-)+c(CH3COO-)=c(Na+),而根据物料守恒可知②c(CH3COO H)+c(CH3COO-)=c(Na+),根据①②可得:c(CH3COOH)=c(Cl-),
故答案为:=;根据电荷守恒有:c(OH-)+c(Cl-)+c(CH3COO-)=c(H+)+c(Na+) 溶液的pH=7,则c(OH-)=c(H+),所以①c(Cl-)+c(CH3COO-)=c(Na+);而根据物料守恒可知:②c(CH3COOH)+c(CH3COO-)=c(Na+),①②结合可知:c(CH3COOH)=c(Cl-);
(3)当加入盐酸的体积为20.0mL时,两种物质刚好完全反应,生成c(CH3COOH)=0.10mol/L,
CH3COO-+H2O?CH3COOH+OH-
起始时各物质浓度/mol•L-1 0.10 0 0
平衡时各物质浓度/mol•L-1 0.10-1.3×10-3≈0.10 1.3×10-3 1.3×10-3
CH3COH的电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{(1.3×1{0}^{-3})^{2}}{0.10}$=1.7×10-5,
答:CH3COH的电离平衡常数Ka=1.7×10-5.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及化学计算能力.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.2mol | B. | 1.2mol | C. | 0.6mol | D. | 1.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL1mol/L的碳酸钠溶液中含有CO32-为1NA | |
| B. | 常温、常压下,0.5mol臭氧中含有氧原子为1.5NA | |
| C. | 标准状况下,1mol NO2气体与水反应生成NO3-为NA | |
| D. | 78gNa2O2中含有O2-为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.6 kJ•molˉ1 | |
| B. | 2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ | |
| C. | 相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量 | |
| D. | 拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打--NaHCO3 | B. | 胆矾--ZnSO4 | C. | 酒精--C2H5OH | D. | 生石灰--Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| B. | 加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖 | |
| C. | 油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 可以用蛋白质的焰色反应,来鉴别部分蛋白质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com