
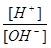 =10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是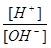 =10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,以此解答该题.
=10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,以此解答该题.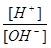 =10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,则c(OH-)=c(H+)=10-7 mol/L,
=10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,则c(OH-)=c(H+)=10-7 mol/L,

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:不详 题型:填空题
 ,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液, 示)
示)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5 |
| B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5 |
| C.向溶液中通入Cl2,在通入NH3调节至pH4- |
| D.向溶液中通入H2O2, 再加入CuO粉末调节至pH4-5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.pH=3的一元酸HX溶液和pH =11的一元碱MOH溶液等体积混合: c(M+)=c(X)>c(H+)=c(OH-) |
| C.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液: c(CH3COO-)>c(CO32-)>c(C6H5O-) |
| D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中的 c(OH-)=1×10 -10mol·L-1 |
| B.溶液中的c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.溶液中的c(H+)+ c(NH4+)= c(Cl-)+ c(OH-) |
| D.溶液中的c(NH3·H2O)= c(NH4+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) |
| B.c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| C.c(Na+)=c(HS-)+2c(H2S)+2c(S2-) |
| D.c(OH-)=c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结
的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结 合时生成剧毒的HCN。完成下列问题:
合时生成剧毒的HCN。完成下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若Va=Vb,则混合后溶液pH=7 |
| B.若Va>Vb,则混合后溶液pH一定小于7 |
| C.若Va=Vb,则盐酸与氨水恰好完全中和 |
| D.若Va=Vb,混合后溶液中微粒浓度的关系可能为: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com