
| A. | sp3、sp2 | B. | sp3、sp | C. | sp2、sp | D. | sp2、sp3 |
科目:高中化学 来源: 题型:解答题
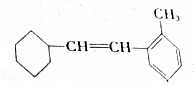 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
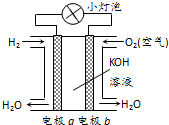
| A. | 电极a是负极 | |
| B. | 电极a上的电极反应为2H2-4e-=4H+ | |
| C. | 外电路中电子由电极a流向电极b | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子半径、失电子能力随核电荷数的增加而增大 | |
| B. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随核电荷数的增加而加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径为20 nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步反应均为氧化还原反应 | |
| C. | 光导纤维是一种新型硅酸盐材料 | |
| D. | 可溶性铁盐和铝盐可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素最高价氧化物对应水化物的化学式可表示为H2YO3 | |
| B. | Z和M组成的化合物与盐酸反应可以生成两种盐 | |
| C. | X、Y、Z元素的气态氢化物中,Y的沸点最高 | |
| D. | 四种元素简单离子的半径由大到小依次为Y>X>Z>M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②⑤不可以 | D. | ③④可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com