
| A、滴入KSCN溶液 | B、通入氯气 | C、加入铁粉 | D、加硫酸酸化的H2O2 |


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
下列各组物质中,X是主体物质,Y是少量杂质,Z是要除去杂质而加入的试剂,其中正确的组别是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用玻璃棒蘸取NaOH溶液,滴在pH试纸上,马上和比色卡对照,确定NaOH的pH | B、滴定用的滴定管、锥形瓶和配制一定物质的量浓度溶液用的容量瓶,使用前均要润洗 | C、均不能采取将溶液直接蒸干的方法制得AlCl3、Al2(SO4)3、FeCl3、Fe2(SO4)3 | D、因为Ksp(CaCO3)<Ksp(CaSO4),所以可用Na2CO3和HCl除去水垢中的CaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
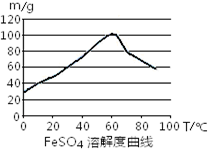 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.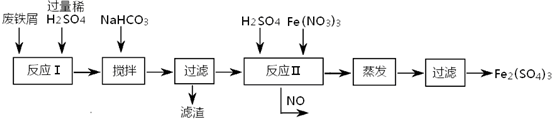
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com