
【题目】在一定条件下,A、B反应生成C和D,在2L的密闭容器中进行,起始时加入了4molA和2molB,经过一段时间达到反应限度,测得C的浓度为1mol/L,D的平均反应速率为0.2 mol·L-·min-,A与B都反应了50%,且D与A的化学计量数相同,请回答下列问题:
(1)达到反应限度这段时间内A的反应速率为______________。
(2)写出该反应的化学方程式:________________________________。
(3)达到化学反应限度所用的时间为_________。
科目:高中化学 来源: 题型:
【题目】已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积。
(2)反应生成的MnCl2的质量为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盛有NO和NO2 的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半.
(1)写出有关反应的化学方程式.
(2)原混合气体中NO和NO2的体积比是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是周期表前四周期的元素,原子序數依次增大。A的基态原子2p能级上有2个单电子;C是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一;D与F不同周期,但最外能层电子数相等。
(1)写出基态C原子的电子排布式: ____________。
(2)A、B、C三种元素第一电离能最大的是____________。(用元素符号表示),其原因是____________。
(3)B、C两元素形成的化合物B2C的分子空间构型为____________。与B2C互为等电子体的粒子的化学式为____________。(填一种)。
(4)D、E形成的一种离子化合物,在晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为ncm,阿伏加德罗常数为NA,求晶胞的密度ρ=_______g/cm3(用含n、NA的计算式表示)。
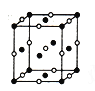
(5)由F原子形成的晶胞结构如图,F原子的半径为r,列式表示F原子在晶胞中的空间利用率:__________________(不要求计算结果)。
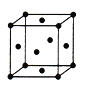
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4 . 0.5molCH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H═+890 kJ?mol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ?mol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═﹣890 kJ?mol﹣1
D.![]() CH4(g)+O2(g)═
CH4(g)+O2(g)═ ![]() CO2(g)+H2O(l)△H═﹣890 kJ?mol﹣1
CO2(g)+H2O(l)△H═﹣890 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是
A.碳酸氢钠可用于焙制糕点
B.木材纤维和土豆淀粉遇碘水均显蓝色
C.漂白粉可用于游泳池用水的消毒
D.聚乙烯塑料可用于制造包装材料、农用薄膜等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、W六种元素在周期表中的位置如图所示,下列说法不正确的是
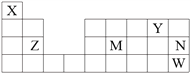
A. 原子半径:r(Z)>r(M)>r(Y)
B. 最高价氧化物对应水化物酸性:M>N
C. N的单质能与Z和W形成的化合物发生置换反应
D. X能与另五种元素形成化合物,且X的化合价不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡.其初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.该反应可表示为X+3Y2Z
B.反应达到平衡时,X的转化率为50%
C.前5min 以Y表示的平均反应速率为υ(Y)=0.01 molL﹣1min﹣1
D.增大压强使平衡向生成Z的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________。
Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

(2) “酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4生成1molPbSO4转移电子的物质的量为____________mol。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示:
NaHPbO2(aq),其溶解度曲线如图所示:

②粗品PbO中所含杂质不溶于NaOH溶液。
结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量__________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,___________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl2的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。

①阴极的电极反应式为_______________________。
②电解一段时间后,Na2PbCl4浓度极大减小,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com