
【题目】某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验
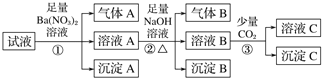
下列有关判断正确的是
A. 原溶液中一定有.Fe2+、Al3+、SO42-、NH4+、H+
B. 原溶液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中反应的离子方程式为2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D. 气体A、B之间肯定不能发生反应
【答案】B
【解析】
根据题意知,强酸性溶液中一定不存在CO32﹣,Fe2+ 和NO3﹣不能同时存在;试液中加入足量硝酸钡溶液生成沉淀A,则该沉淀A为BaSO4沉淀,说明溶液中含有SO42﹣离子,一定不含Ba2+离子;生成气体A,气体A为NO,说明溶液中含有还原性离子为Fe2+离子,一定不含NO3﹣。溶液A中加入足量NaOH溶液,生成气体B,则B为NH3,说明溶液中含有NH4+离子;沉淀B为氢氧化铁。溶液B中通入CO2气体,生成沉淀C,沉淀C中一定含有碳酸钡,可能含有氢氧化铝。综上所述,该溶液中一定不含Ba2+、CO32﹣、NO3﹣,一定含有Fe2+、SO42﹣、H+、NH4+,Al3+和Cl﹣无法确定。A、原溶液中一定有Fe2+、SO42﹣、H+、NH4+,Al3+和Cl﹣无法确定,选项A错误;B、原溶液中一定没有Ba2+、CO32﹣、NO3﹣,选项B正确;C、步骤③中反应的离子方程式一定有Ba2+ + 2OH- + CO2=BaCO3↓ + H2O,可能含有2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣,选项C错误;D、气体A为NO,气体B为NH3,二者之间可能发生反应生成氮气和水,选项D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
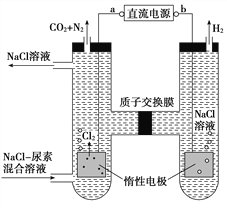
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究者设计利用芳香族化合物的特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已省略):
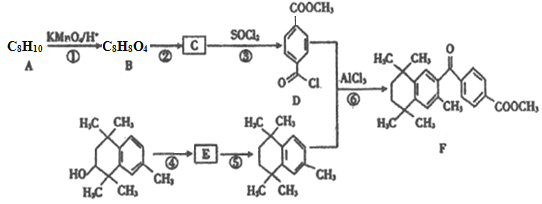
已知:I. 
Ⅱ. ![]()
回答下列问题:
(1)B的名称是______________。
(2)反应⑤所属的反应类型为______________。
(3)反应⑥的化学方程式为___________________________。
(4)芳香族化合物X是C的同分异构体,只含一种官能团且1molX与足量 NaHCO3溶液发生反应生成2 molCO2,则X的结构有_______种。其中核磁共振氢谱显示有4组峰,且峰面积之比为3:2:2:1的结构简式为______________。
(5)写出以乙醇和甲苯为原料制备 的路线(其他无机试剂任选)___________________。
的路线(其他无机试剂任选)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时发生反应CO(g)+2H2(g) ![]() CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

(1)图中表示CH3OH 的变化的曲线是_______;
(2)下列措施不能提高反应速率的有_________(请用相应字母填空);
a.升高温度 b.加入催化剂 c.增大压强 d.及时分离出CH3OH
(3)下列叙述能说明反应达到平衡状态的是__________(请用相应字母填空);
a.CO和H2的浓度保持不变 b.v(H2)=2 v(CO)
c.CO的物质的量分数保持不变 d.容器内气体密度保持不变
e.每生成1molCH3OH的同时有2molH-H键断裂
(4)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图所示,图中CH3OH从__________(填A或B)通入,b极的电极反应式是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳铵是一种较常使用的化肥,它在常温下易分解.某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究.
(定性实验)检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色.
(1)根据实验现象,推测碳铵中所含有阴离子可能是_________和__________;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是________________;
(定量试验)测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示.
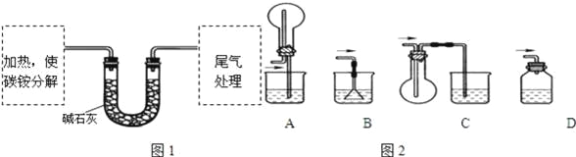
(3)碳铵固体应放在________中进行加热.
A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
(4)从安全的角度考虑,尾气处理的装置可以选用如图2中的___________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中所含c(Cl-)最大的是
A. 50mL0.1mol·L-1AlCl3溶液 B. 100mL0.1 mol·L-1MgCl2溶液
C. 150mL0.3 mol·L-1KClO3溶液 D. 200mL0.2 mol·L-1NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将可能混有NaOH的16.80gNaHCO3固体,在200℃条件下充分加热,排出反应产生的气体,得到固体的质量为bg。
(1)b的最小值为___________。
(2)当b=____________时,产物中水的质量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度/(gcm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
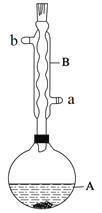
实验步骤:
在A中加入4.4 g异戊醇(3-甲基-1-丁醇)、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的具体名称是____________,实验时冷却水的进水口是_____(a或b)。
(2)在洗涤操作中,先水洗再饱和NaHCO3溶液洗而不是直接用饱和NaHCO3溶液洗涤的原因是____________________。
(3)该制备反应的化学反应方程式为__________________________。
(4)本实验中加入过量乙酸的目的是___________________________。
(5)本实验中不能用生石灰代替无水MgSO4的原因________________________。
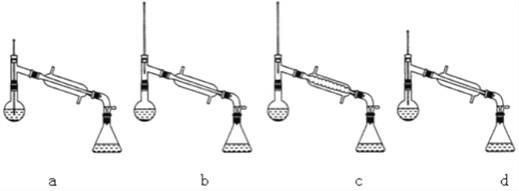
(6)在蒸馏操作中,仪器选择及安装都正确的是___________(填标号)。
(7)本实验的产率是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。

(1)若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为____,当有1.6g负极材料溶解时,转移的电子为____mol;
(2)若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为______→ __________(填电极材料,下同),溶液中的NO3-向________极移动;
(3)氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为________________。
Ⅱ.已知H-H 键、N-H 键、N≡N 键的键能分别为 436kJ/mol、391kJ/mol、946 kJ/mol,关于工业合成氨的反应,请根据键能的数据判断下列问题:
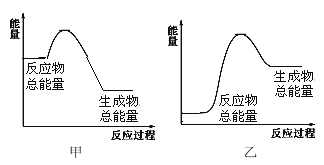
(4)若有 1 mol NH3生成 ,可________(填“吸收”或“放出”)热量________kJ;该反应的能量变化可用图__________表示。(填“甲“或“乙”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com