
现有(NH4)2SO4、NH4NO3两种化肥,你认为哪种适宜用于酸性土壤?说明理由。
科目:高中化学 来源:2014年高二化学苏教版选修2 模块综合检测练习卷(解析版) 题型:选择题
污水处理的主要方法有:①中和法;②化学沉淀法;③氧化还原法;④过滤法。其中属于化学方法的有( )。
A.①②③ B.①②④
C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 5专题综合检测练习卷(解析版) 题型:选择题
2005年“禽流感”在全球蔓延,百姓谈“禽”色变。目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒的特效药物。下列有关描述正确的是( )。
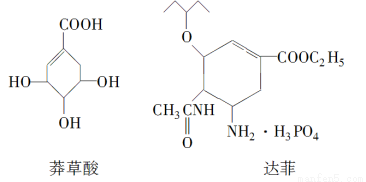
A.高温、紫外线都能使禽流感病毒失去生理活性
B.莽草酸既能与H2发生加成反应,又能与FeCl3溶液反应显紫色
C.莽草酸、达菲都能使溴水和酸性KMnO4溶液褪色
D.1 mol达菲与NaOH溶液反应,消耗NaOH的物质的量最多为3 mol
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 5.3无土栽培技术练习卷(解析版) 题型:选择题
为了探究植物吸水和吸收矿质离子的特点和关系,用相同的培养液,分别培养水稻和番茄幼苗。培养一段时间后,分别测定培养液中各种养分的百分含量,并与原培养液(各种养分的相对百分含量100%)中各种养分的百分含量比较,结果如图所示。请据图回答相关问题:
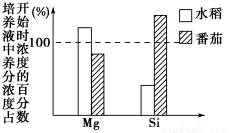
(1)水稻的培养液中,Mg2+的相对浓度比原来升高了,这是由于水稻______________________________________________________________。
(2)番茄的培养液中,Mg2+和Si4+的浓度变化不同,说明______________________________________________________________。
(3)培养水稻和番茄的培养液中,Si4+的浓度变化不同,说明______________________________________________________________。
(4)为使上述结果反映水稻和番茄吸水和吸收矿质营养的特点,除把实验装置放在同一环境中外,还应将培养容器密封好,防止________;注意调节培养液的酸碱度,并经常(每天2~3次)向培养液中通入________,保证根细胞______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 5.2化肥的生产与合理使用练习卷(解析版) 题型:填空题
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。

(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:______________________________________________________________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:_______________________________________________________________。
(5)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
温度/℃ | 0 | 20 | 60 |
K2SO4溶解的量/g | 7.4 | 11.1 | 18.2 |
60 ℃时K2SO4的饱和溶液591 g冷却到0 ℃,可析出K2SO4晶体________g。
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是________。
a.熔点较低(29 ℃熔化) b.能导电
c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 4专题综合检测练习卷(解析版) 题型:填空题
获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动。信息产业的核心材料是高纯度的硅,单晶硅可用来制作大规模集成电路、整流器等,硅纯度越高,大规模集成电路的性能就越好。高纯度的单晶硅生产方法有:
方法一:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

方法二:用金属硅化物(Mg2Si)与盐酸作用制得硅烷,再热分解硅烷可得高纯硅。
根据上述信息回答以下问题:
(1)从方法一生产单晶硅的过程看,由焦炭还原得到的硅为何还要进一步处理?_________________________________________________________。
(2)写出方法二中生产高纯硅的两个化学方程式:
①____________________________________________________________;
②__________________________________________________________。
(3)写出由纯SiHCl3制备高纯硅的化学方程式:____________________________________。
(4)在方法一中,整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_____________________________________________________。
(5)比较方法一和方法二,分析一下各自的优缺点____________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 4专题综合检测练习卷(解析版) 题型:选择题
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)  Si(s)+4HCl(g)ΔH=+Q kJ·mol-1(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )。
Si(s)+4HCl(g)ΔH=+Q kJ·mol-1(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )。
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·(L·min-1)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 4.2材料组成的优化练习卷(解析版) 题型:选择题
工业上由粗硅制取高纯硅有以下反应:①Si(s)+3HCl(g)=SiHCl3(g)+H2(g) ΔH=-381 kJ·mol-1;
②SiHCl3(g)+H2(g)=Si(s)+3HCl(g)。对上述反应的说法中正确的是( )。
A.均为置换反应和氧化还原反应
B.反应①、②实际上互为可逆反应
C.由于反应①放热,则反应②可能是吸热的,也可能是放热的
D.提高SiHCl3产率,应采用加压和升温的办法
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题1物质的组成分类变化和用语练习卷(解析版) 题型:选择题
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂,干燥的高铁酸钾在198 ℃以下是稳定的,受热易分解。高铁酸钾在水处理过程中涉及的变化过程有( )
①蛋白质的变性②蛋白质的盐析③胶体聚沉④盐类水解
⑤焰色反应⑥氧化还原反应
A.①②③④ B.①③④⑥ C.②③④⑤ D.②③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com