
| A. | Ksp(AB2)<Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| B. | 在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp不变 | |
| C. | 已知Ksp(AgCl)>Ksp(AgI),则反应AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 | |
| D. | 在CaCO3的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动 |
分析 A.由于AB2与CD分子组成形式不同,因此不能根据Ksp大小来比较溶解度的大小;
B.KSP只与温度有关,与浓度无关;
C.溶解度大的能转化为溶解度小的;
D.HCl与CO32-反应,促进碳酸钙的沉淀溶解平衡向正方向移动.
解答 解:A.由于AB2与CD分子组成形式不同,KSP的表达式不同,因此不能根据KSP大小来比较溶解度的大小,故A错误;
B.KSP只与温度有关,与浓度无关,在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp不变,故B正确;
C.溶解度大的能转化为溶解度小的,所以在AgCl的沉淀溶解平衡体系中,加入KI固体,AgCl沉淀可转化为AgI沉淀,即反应AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生,故C正确;
D.碳酸钙的沉淀溶解平衡为:CaCO3(s)?Ca2+(aq)+CO32-(aq),加入HCl能与CO32-反应,促进碳酸钙的沉淀溶解平衡向正方向移动,故D错误;
故选BC.
点评 本题考查了Ksp的比较、沉淀的转化、影响Ksp的因素、沉淀溶解平衡的移动等,属于基本原理的应用的考查,题目难度不大,明确溶度积常数和沉淀溶解平衡是解题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
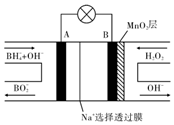 新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )| A. | 纳米MnO2层的作用是提高原电池的工作效率 | |
| B. | 放电过程中,Na+从B极区移向A极区 | |
| C. | 电池负极的电极反应为:BH4+8OH--8e一═BO2-+6H2O | |
| D. | 在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是亲氧元素,在自然界中以化合态存在 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位 | |
| C. | 硅的活泼性比碳强,只有在高温下才能跟氢气起化合反应 | |
| D. | 二氧化硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L的FeCl3溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1 NA | |
| B. | 7.8 gNa2O2中含有的离子总数目为0.4 NA | |
| C. | 标准状况下,44.8 L HF所含分子数为2 NA | |
| D. | 标准状况下,80 gSO3中所含的原子数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构式为CH2=CH2 | |
| B. | CH2Cl2属于正四面体的空间结构 | |
| C. | 乙炔是含碳量最高的烃 | |
| D. | 正戊烷分子中所有碳原子一定不在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
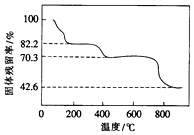 硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.
硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.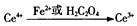
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | 非金属性:Cl>C>S |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO32-中的一种或几种 |
| C | 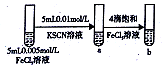 | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 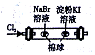 | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 NaCl溶液中含有Na+个数为NA | |
| B. | 标准状况下,22.4 L H2O含有的水分子数为NA | |
| C. | 71g氯气与足最铁粉充分反应,转移的电子数为3NA | |
| D. | 标准状况下,16g O2和O3的混合气体中原子总数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com