
【题目】下列药品保存方法,正确的是 ( )
A. 乙醇密封保存,放置于阴凉处
B. 氢氧化钠溶液用橡胶塞密封保存在细口瓶中
C. 浓硫酸保存在广口瓶中,没有挥发性,无须密封
D. 金属钠和钾等很活泼的金属可以保存在煤油或石蜡中
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知X(g)+ 3Y(g) = 2Z(g) ΔH>0,下列对该反应的说法中正确的是( )
A.ΔS>0B.能自发进行
C.反应物总能量大于生成物总能量D.在任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年3月日本地震引起福岛核反应堆事故,冷却反应堆需要大量的水。下列有关说法正确的是( )。
A.H2O分子中只含有非极性共价键
B.H2O分子中只含有极性共价键
C.水分子间只存在氢键
D.冷却反应堆用水在地球上常温下是固态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应xM (g)+yN(g)![]() zP(g)。平衡时测得M的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得M的浓度降低为0. 30 mol/L。下列有关判断正确的是
zP(g)。平衡时测得M的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得M的浓度降低为0. 30 mol/L。下列有关判断正确的是
A. x+y<z B. 平衡向正反应方向移动
C. N的转化率降低 D. 混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如下图所示。

该方案的实验原理是自发进行的氧化还原反应可以设计为原电池。写出该氧化还原反应的离子方程式:__________。该装置中的负极材料是______(填化学式),正极反应式是_______。
(2)某研究性学习小组为证明2Fe3++2I-2Fe2++I2为可逆反应,设计如下两种方案。
方案一:
取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,再继续加入2mLCCl4,充分振荡、静置、分层,再取上层清液,滴加KSCN溶液。
①方案一中能证明该反应为可逆反应的现象是______。
②有同学认为方案一设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是(用离子方程式表示)_____。
方案二:
设计如下图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右管中加入1mol/L FeCl2溶液。

③方案二中,“读数变为零”是因为____________.
④“在右管中加入1mol/L FeCl2溶液”后,观察到灵敏电流计的指针______偏转(填“向左”、“向右”或“不”),可证明该反应为可逆反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题:
(1)在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是_____________(填序号)。
(2)蒸发皿的使用:把滤液倒入蒸发皿中,再把蒸发皿放到铁架台的铁圈上。用酒精灯加热,同时用玻璃棒不断搅拌,以防止___________。当蒸发皿里的液体较少时,则应____________________,利用余热,使剩余溶剂挥发。
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体。可供选择的液体试剂(固体试剂任选)有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。请回答下列问题:

①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为____,制取该气体利用了B的性质有____、___________。
②通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为____;若在乙中收集氨气,气体流经装置的顺序是a→___→___→d(填接口代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,都是强电解质的是( )
A.HNO3、HCl、BaSO4B.NH4Cl、CH3COOH、Na2S
C.NaOH、Ca(OH)2、NH3·H2OD.HClO、CH3COONa、Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
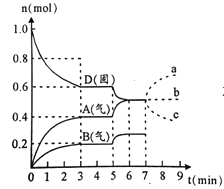
A. 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.0667 mol/(L·min)
B. 该反应的化学方程式为2D(s) 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B)
C. 已知:反应的H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
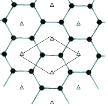
【题目】1-36号A、B、C、D、E、F六种元素,其中A、B、C、D、E的原子序数均小于18且其核电荷数依次递增,B元素基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,D原子的价电子排布为ns2np2n+2,E原子第一至第四电离能(kJ·mol-1)分别为:738、1451、7733、10540。F2+离子K、L、M层全充满。根据以上信息,同答下列问题:
(1)BA4D和BA2D,沸点较高的是________(填相关物质的结构简式)
(2)已知B与A形成的化合物在标准状况下的密度为1.16g·L-1,则在该化合物分子空间构型_________,在该化合物分子中含有σ键和π键个数比__________。
(3)写出单质F与足量C的最高价氧化物对应的水化物稀溶液反应,C被还原到最低价,该反应的化学方程式________________________
(4)B的单质是一种层状结构,元素B和E的形成一种合金,E的原子位于B的层间,其投影位于层面六圆环的中央,“△”表示E的原子位置,平行四边形表示在此二维图形上画出的一个晶胞,该合金的化学式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com