
【题目】H2Y2-是乙二胺四乙酸根(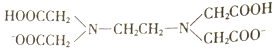 )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。
I. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) △H<0
FeY2-(NO)(aq) △H<0
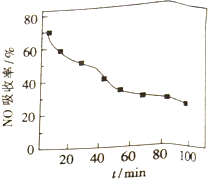
(1)将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如右图。时间越长,NO吸收率越低的原因是_________。
(2)生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理:FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。
若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为_______。
II.络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
(1)H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
络合反应 | lgK(K为平衡常数) |
Cu2++H2Y2- | 18.8 |
Fe3++H2Y2- | 25.1 |
Ca2++H2Y2- | 10.7 |
①表中最不稳定的金属络合物是_____(填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为________(填化学式)。
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于________(常温下Ksp[Cu(OH)2]= 2.2×10-20)。
(2)羟基自由基(-OH)、Na2FeO2都可氧化络合铜中的Y4-而使Cu2+得到解离。
①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为___________________。
②Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,/span>废水处理效果越好,这是因为______________。

【答案】 反应放热,温度升高,不利于NO的吸收;随着反应进行,FeY2-浓度降低 0.1mol CaY2- Fe3+ 6 40-OH+H12C10N2O84-+4H+=10CO2↑+N2↑+28H2O 酸性越强,Na2FeO4越容易分解;pH越大,Cu2+更容易沉淀;Na2FeO4氧化Y4-,自身被还原成Fe3+,水解产生的Fe(OH)3胶体有絮凝作用,使Cu(OH)2更易沉降
【解析】I.(1)根据反应FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) △H<0可知,反应放热,温度升高,不利于NO的吸收;随着反应进行,FeY2-浓度降低,时间越长,NO吸收率越低;(2)根据反应FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3中铁化合价由0变为+2价,氮元素化合价由+2价变为了3价,最小公倍数为10,配平得反应2FeY2-(NO)(aq)+5Fe+8H2O=2FeY2-(aq)+5Fe(OH)2+2NH3,若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为
FeY2-(NO)(aq) △H<0可知,反应放热,温度升高,不利于NO的吸收;随着反应进行,FeY2-浓度降低,时间越长,NO吸收率越低;(2)根据反应FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3中铁化合价由0变为+2价,氮元素化合价由+2价变为了3价,最小公倍数为10,配平得反应2FeY2-(NO)(aq)+5Fe+8H2O=2FeY2-(aq)+5Fe(OH)2+2NH3,若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为![]() ;II. (1)根据表中数据可知,lgK越小,K越小,络全反应逆向移动,络合物越不稳定,则最不稳定的金属络合物是CaY2-;向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为Fe3+,根据lgK大小可知,加入Fe3+,平衡Fe3++H2Y2-
;II. (1)根据表中数据可知,lgK越小,K越小,络全反应逆向移动,络合物越不稳定,则最不稳定的金属络合物是CaY2-;向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为Fe3+,根据lgK大小可知,加入Fe3+,平衡Fe3++H2Y2-![]() FeY-+2H+正向移动,H2Y2-浓度降低,平衡Cu2++H2Y2-
FeY-+2H+正向移动,H2Y2-浓度降低,平衡Cu2++H2Y2-![]() CuY2-+2H+逆向移动,可解离出Cu2+;②常温下Ksp[Cu(OH)2]= c(Cu2+)c2(OH-) =2.2×10-20,若要使c(Cu2+)≤2.2×10-4mol/L,则c2(OH-)
CuY2-+2H+逆向移动,可解离出Cu2+;②常温下Ksp[Cu(OH)2]= c(Cu2+)c2(OH-) =2.2×10-20,若要使c(Cu2+)≤2.2×10-4mol/L,则c2(OH-)![]() ,c(OH-)
,c(OH-)![]() ,pH应不低于6;(2)①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。反应的离子方程式为40-OH+H12C10N2O84-+4H+=10CO2↑+N2↑+28H2O;②根据图中曲线变化可知。pH越大,废水处理效果越好,这是因为酸性越强,Na2FeO4越容易分解;pH越大,Cu2+更容易沉淀;Na2FeO4氧化Y4-,自身被还原成Fe3+,水解产生的Fe(OH)3胶体有絮凝作用,使Cu(OH)2更易沉降。
,pH应不低于6;(2)①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。反应的离子方程式为40-OH+H12C10N2O84-+4H+=10CO2↑+N2↑+28H2O;②根据图中曲线变化可知。pH越大,废水处理效果越好,这是因为酸性越强,Na2FeO4越容易分解;pH越大,Cu2+更容易沉淀;Na2FeO4氧化Y4-,自身被还原成Fe3+,水解产生的Fe(OH)3胶体有絮凝作用,使Cu(OH)2更易沉降。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】化合物E是一种合成高血压药物的中间体,其合成路线流程图如下:

(1)  中所含官能团名称为_____和______。
中所含官能团名称为_____和______。
(2)苯环上的硝基对新引入基团的位置会产生一定的影响,如:
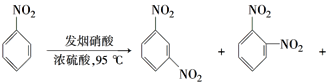 (产物中,间二硝基苯占93%)苯经两步反应制得A,第一步反应的条件为_________。
(产物中,间二硝基苯占93%)苯经两步反应制得A,第一步反应的条件为_________。
(3)写出同时满足下列条件的B的一种同分异构体X的结构简式: _________。
①含有两个苯环,分子中有6种不同化学环境的氢;
②既能与盐酸反应,又能与NaHCO3溶液反应。
(4)合成E时,还可能生成一种与E互为同分异构体的副产物Y,Y的结构简式为______。
(5)常温下,苯酚在Br2的CCl4溶液中发生取代反应,得到一溴代物。请写出以苯酚、CCl4为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对Mg和Al的性质进行了下列的实验及研究。

(1)以镁条、铝片为电极,稀NaOH溶液为电解质构成的原电池(如图1所示)时发现,刚开始时,电流表指针向右偏转,镁条做负极;但随后很快指针又向左偏转,镁条表面有极少量的气泡产生。
①开始阶段,负极发生的反应是________。
②随后阶段,铝片发生的电极反应式是_______;则镁电极发生的电极反应式是________。
(2)经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如图2所示,溶液中的产物有Mg(NO3)2、NH4NO3和H2O。96 mg Mg在1 L 4molL﹣1的HNO3中完全溶解,并可收集到22.4mL(标准状况下)气体(忽略反应过程中HNO3浓度的变化),该反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol/L的Na2SO4溶液是 ( )
A. 溶液中含有1mol Na2SO4
B. 1升水中加入142g Na2SO4
C. 1mol Na2SO4溶于1mol水中
D. 将322g Na2SO4·10H2O溶于少量水后再稀释成1000mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18 g·mL-1,质量分数为36.5%浓盐酸配制250 mL 0.1 mol·L-1 的盐酸,填空并回答下列问题:
(1)配制250 mL 0.1 mol·L-1的盐酸___________。
应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 容量瓶外还需的其他仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________。
A.用30 mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是___________,溶液注入容量瓶前需恢复到室温,这是因为___________;
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线___________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:____Mo+____HF+____HNO3=____ MoO2F2+____ MoOF4+____NO2↑+____ _________
(2)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =_________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(3)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH__0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A. 若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B. 若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C. 若a>b且c(X-)= c(Y-),则酸性HX>HY
D. 若两溶液等体积混合,则c(Na+)="(a+b)" mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com