

| 元素 | Mn | Fe | |
| 电离能(KJ•mol-1) | Ⅰ1 | 717 | 759 |
| Ⅰ2 | 1509 | 1561 | |
| Ⅰ3 | 3248 | 2957 | |
分析 (1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素;
(2)P原子只有5个价电子,PCl6-呈正八面体的结构,P原子形成了6个共价键,有一个配位键;根据SF6中的将一个F、两个F、三个F、四个F、五个F、六个F等依次被氯取代,据此判断分子种数;
(3)原子轨道中电子处于全满、全空、半满时最稳定;根据价层电子对互斥理论确定杂化方式;原子个数相等价电子数相等的微粒为等电子体.
解答 解:(1)根据图片知,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素,所以硼B元素是⑤,②为氮元素,③为氧元素,
故答案为:⑤、③;
(2)P原子的原子序数为15,基态氮原子的价电子排布式是1s22s22p63s23p3,只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键,
在SF6中的将一个F被氯原子取代有一种,两个F原子被取代有2种(相邻和相对),三个F被取代有2种(共平面、共体面),四个F被取代、五个F被取代对应二取代、一取代的结构种数相同,分别为2种、1种,别外全取代有1种,所以共有9种,故选:C,
故答案为:是;P原子只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键;C;
(3)原子轨道中电子处于全满、全空、半满时最稳定,Mn2+的3d轨道电子排布为半满状态较稳定,CN-中C原子与N原子键以三键连接,三键中有1个δ键、2个π键,C原子还有一对孤对电子,杂化轨道数2,C原子采取sp杂化.CN-含有2个原子,价电子总数为4+5+1=10,故其等电子体为氮气分子等,结构式为N≡N,
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定;sp;N≡N.
点评 本题通过考查SF6的分子结构实际上是考查了同分异构现象、杂化轨道类型的判断、等电子体等知识,难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径的大小顺序:r(W)>r(Y)>r(Z) | |
| B. | 元素Z、W 的简单离子的电子层结构不同 | |
| C. | 元素Y 的简单气态氢化物的热稳定性比Z 的强 | |
| D. | W、Y、Z 三种元素的氢化物中,W的熔点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 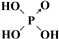 | 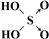 | 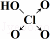 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铁的质量为5.6g | |
| B. | 合金与稀硫酸反应共生成0.45mol H2 | |
| C. | 该合金与足量氢氧化钠反应,转移的电子数为0.6NA | |
| D. | 所加的稀硫酸中含0.6molH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
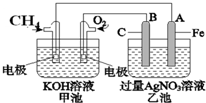 如图是一个电化学过程的示意图.已知甲池的总反应式为
如图是一个电化学过程的示意图.已知甲池的总反应式为查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44.5kJ/mol | B. | 1364.7kJ/mol | C. | 2729.3kJ/mol | D. | 89.0kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com