
| A. | 可逆反应的化学平衡常数K | B. | 0.1mol/LCH3COONa溶液的PH | ||
| C. | 水的离子积常数Kw | D. | 弱电解质的电离程度 |
分析 A、根据勒夏特列原理,对所有可逆反应升温平衡都向吸热的方向移动.可逆反应的正反应既有吸热反应也有放热反应,要区别对待;
B、盐类水解是吸热反应,升高温度促进其水解;
C、水的电离过程是吸热的,升高温度促进水的电离;
D、电离吸热,温度改变会影响弱电解质的电离.
解答 解:A、若正反应为放热反应,升高温度平衡向逆反应移动,化学平衡常数减小,若正反应为吸热反应,升高温度平衡向正反应移动,化学平衡常数增大,可逆反应的化学平衡常数K不一定增大,故A正确;
B、醋酸钠水解吸热,升温能够促进其水解,碱性增强,pH增大,故B错误;
C、水的电离过程是吸热的,升高温度促进水的电离,升高温度电离程度增大,水的离子积一定增大,故C错误;
D、电离是吸热过程,升温促进弱电解质的电离,电离度增大,故D错误;
故选A.
点评 本题考查温度对水的离子积、电离平衡常数、盐类水解以及化学平衡常数的影响,比较基础.注意温度对化学反应速率和化学平衡影响的区别,不要混淆,题目较简单.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸钡的水溶液几乎不导电,所以硫酸钡是弱电解质 | |
| B. | 二氧化硫和二氧化氮的水溶液都能导电,所以二者都是电解质 | |
| C. | 氨气的水溶液可以导电,所以氨是电解质 | |
| D. | 氢氧化钙在水中的溶解度很小,但它溶解的部分完全电离,所以氢氧化钙是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
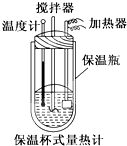 已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:
已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化合物中,σ键比π键重叠程度大,形成的共价键强 | |
| B. | N2H4分子中有5个σ键 | |
| C. | 气体单质中,一定有σ键,可能有π键 | |
| D. | 两种原子间形成共价键时,最多有一个σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用作木材的防火剂 | |
| B. | Na2O2可用于潜水员的呼吸面具中的供氧剂 | |
| C. | 对“地沟油”蒸馏可以获得汽油 | |
| D. | 石英具有很好的导光性,可用于生产光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | A原子的1S轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2P轨道中有三个未成对电子 |
| D | D是主族元素且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
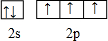
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46C | B. | $\frac{c}{d}$mol | C. | c mol | D. | 1000dw g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 | |
| B. | 一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 非极性共价键只存在于双原子单质分子里 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com