
| A. | CaCl2$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{高温}{→}$CaO | B. | Fe$\stackrel{少量Cl_{2}}{→}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2 | ||
| C. | Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3 | D. | SiO2$\stackrel{水}{→}$H2SiO3$\stackrel{NaOH溶液}{→}$Na2SiO3 |
分析 A.CaCl2与二氧化碳不反应;
B.Fe与氯气反应生成FeCl3;
C.Al2O3与氢氧化钠溶液反应生成偏铝酸钠溶液,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀;
D.二氧化硅与水不反应.
解答 解:A.CaCl2溶液中通入二氧化碳,不发生反应,不能生成碳酸钙沉淀,故A错误;
B.在加热条件或点燃条件下,Fe与氯气反应生成FeCl3,不能生成FeCl2,故B错误;
C.Al2O3是两性氢氧化物,能与氢氧化钠溶液反应生成偏铝酸钠溶液,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀,所以在一定条件下可以转化,故C正确;
D.二氧化硅与水不反应,所以二氧化硅与水不能生成硅酸,故D错误.
故选C.
点评 本题考查了常见元素化合物的性质,明确物质间的转化关系是解题的关键,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
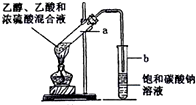 如图为实验室制取乙酸乙酯的装置.
如图为实验室制取乙酸乙酯的装置.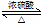 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a气体的相对分子质量一定比b气体的相对分子质量大 | |
| B. | a气体可能是CO,b气体可能是CH4 | |
| C. | A气球中所含气体分子数大于B气球中所含气体分子数 | |
| D. | 充气后,A气球的质量一定大于B气球的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH | |
| D. | 镀层破损后,镀锌铁板比镀锡铁板更易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.84 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
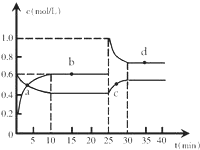 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com