
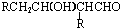 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$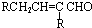
 .
. .
. .
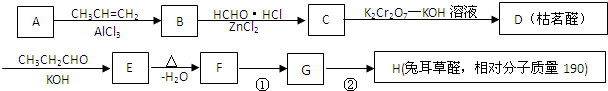
.分析 由D发生反应产物结构,可知D的结构简式为 ,A与丙烯反应生成B,B经过系列反应得到D,由D的结构结合(1)中A分子中碳、氢的质量比为12:1,可知A为
,A与丙烯反应生成B,B经过系列反应得到D,由D的结构结合(1)中A分子中碳、氢的质量比为12:1,可知A为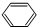 ,与丙烯发生加成反应生成B为
,与丙烯发生加成反应生成B为 ,结合B、D结构可推知C为
,结合B、D结构可推知C为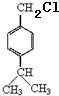 (HCl存在条件下不可能为得到醇羟基),D发生信息中的反应生成E为
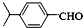
(HCl存在条件下不可能为得到醇羟基),D发生信息中的反应生成E为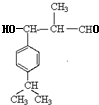 ,E脱去1分子水生成F为
,E脱去1分子水生成F为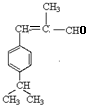 ,H的相对分子质量为190,比F的相对分子质量大2,故组成上比F多2个H原子,应是F中C=C双键与氢气加成,故F中C=C、-CHO与氢气加成生成G,G中醇被氧化为-CHO,则G为
,H的相对分子质量为190,比F的相对分子质量大2,故组成上比F多2个H原子,应是F中C=C双键与氢气加成,故F中C=C、-CHO与氢气加成生成G,G中醇被氧化为-CHO,则G为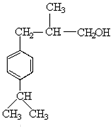 、H为
、H为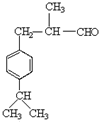 ,据此解答.
,据此解答.
解答 解:由D发生反应产物结构,可知D的结构简式为 ,A与丙烯反应生成B,B经过系列反应得到D,由D的结构结合(1)中A分子中碳、氢的质量比为12:1,可知A为
,A与丙烯反应生成B,B经过系列反应得到D,由D的结构结合(1)中A分子中碳、氢的质量比为12:1,可知A为 ,与丙烯发生加成反应生成B为
,与丙烯发生加成反应生成B为 ,结合B、D结构可推知C为
,结合B、D结构可推知C为 (HCl存在条件下不可能为得到醇羟基),D发生信息中的反应生成E为
(HCl存在条件下不可能为得到醇羟基),D发生信息中的反应生成E为 ,E脱去1分子水生成F为
,E脱去1分子水生成F为 ,H的相对分子质量为190,比F的相对分子质量大2,故组成上比F多2个H原子,应是F中C=C双键与氢气加成,故F中C=C、-CHO与氢气加成生成G,G中醇被氧化为-CHO,则G为
,H的相对分子质量为190,比F的相对分子质量大2,故组成上比F多2个H原子,应是F中C=C双键与氢气加成,故F中C=C、-CHO与氢气加成生成G,G中醇被氧化为-CHO,则G为 、H为
、H为 .
.
(1)由上述分析可知,A为 ,分子式为C6H6,故答案为:C6H6;
,分子式为C6H6,故答案为:C6H6;
(2)D的结构简式为 ,D的键线式为是
,D的键线式为是 ,故答案为:
,故答案为: ;
;
(3)E为 ,含氧官能团有:醛基、羟基,故答案为:醛基、羟基;
,含氧官能团有:醛基、羟基,故答案为:醛基、羟基;
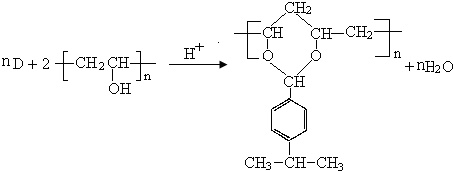
(4)反应①属于加成反应,反应②的化学方程式为: ,
,
故答案为:加成反应; ;
;
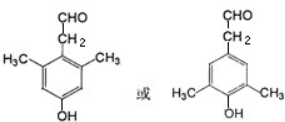
(5)枯茗醛D( )中的含氧官能团易被氧化,醛基氧化为羧基生成化合物I为
)中的含氧官能团易被氧化,醛基氧化为羧基生成化合物I为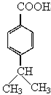 ,I有多种同分异构体,符合下列条①能与新制氢氧化铜加热后反应生成红色沉淀,说明含有醛基;
,I有多种同分异构体,符合下列条①能与新制氢氧化铜加热后反应生成红色沉淀,说明含有醛基;
②能与FeCl3溶液发生显色反应,说明含有酚羟基;
③苯环上一溴取代物只有一种,苯环有一种H原子,
④核磁共振氢谱有五种类型氢原子的吸收峰,则侧链中共有3种H原子,符合条件的同分异构体有: ,
,
故答案为:2; .
.
点评 本题考查有机物推断与合成,关键是利用D发生反应产物结构确定其结构,结合反应信息确定F的结构,根据相对分子质量判断F→G→H发生的反应,进而判断G、H的结构简式,根据D的结构确定A为苯,C的结构推断为难点,题目没有给出相应的信息,但不影响题目解答,(5)中同分异构体的书写是难点、易错点,难度较大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
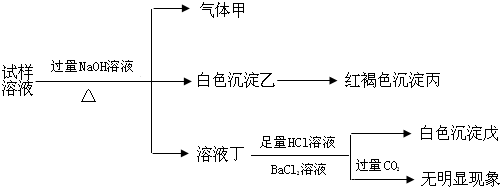
| A. | 试样中肯定有NH4+、SO42-和Fe2+ | |
| B. | 试样中一定没有Al3+ | |
| C. | 若气体甲在标准状况下体积为0.448L,沉淀丙和沉淀戊分别为1.07g和4.66g,则可判断溶液中还有Cl- | |
| D. | 该盐工业上可以用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的NH4Cl和NH3•H2O的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 | |
| B. | 移液管放液时,将移液管稍倾斜放入直立的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 | |
| C. | 生物体死亡后,体内含有的碳-14会逐渐减少,因此可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代.碳-14减少的变化为化学变化 | |
| D. | 当用电解法除去溶液中的Cr2O72-离子时,因其具有强氧化性易得电子,故可在阴极直接放电生成Cr3+,最后生成Cr(OH)3沉淀除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
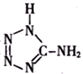 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、MgO、Al2O3都是碱性氧化物 | |
| B. | 硬铝、黄铜、钢铁都属于合金 | |
| C. | 纤维素、硝化纤维、纤维二糖都是高分子 | |
| D. | 蔗糖、乙醇、液氯都是非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com