
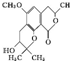
| A. | 每个分子中有2个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1 mol该物质最多可与含2 mol NaOH的水溶液反应 | |
| D. | 分子中有3种含氧官能团 |
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
 为解决能源短缺问题,工业生产中应合理利用化学能.
为解决能源短缺问题,工业生产中应合理利用化学能.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 相关物质 | 相关说法 |
| A | 1mol CH3COONa和少量CH3COOH溶于水所得的中性溶液中 | CH3COO-数目为NA |
| B | Na2O和Na2O2的混合物共1mol | 阴离子数目可能为1.5NA |
| C | 向含2mol H2SO4的浓硫酸中加入足量的Zn粉,加热充分反应 | 转移的电子数为2NA |
| D | 3.0g由淀粉和葡萄糖组成的混合物中 | 所含的碳原子数为0.1NA |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (NH4)2SO4•MnSO4•nH2O(硫酸锰铵)是浅粉色晶体,易溶于水,在农业上用作微量元素肥料,实验室由MnO2制备硫酸锰铵的实验步骤如下:
(NH4)2SO4•MnSO4•nH2O(硫酸锰铵)是浅粉色晶体,易溶于水,在农业上用作微量元素肥料,实验室由MnO2制备硫酸锰铵的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com