
分析 (1)pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性,可知酸过量;
(2)反应生成高锰酸、碘酸和硫酸,则I元素的化合价降低,Mn元素的化合价升高;弱电解质、水在离子反应中保留化学式.
解答 解:(1)pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性,可知酸过量,则H5IO6为弱电解质,故答案为:弱电解质;
(2)反应生成高锰酸、碘酸和硫酸,则I元素的化合价降低,则氧化剂为H5IO6,该反应的离子反应为5H5IO6+2Mn2+=11H++2MnO4-+5IO3-+7H2O,
故答案为:H5IO6;5H5IO6+2Mn2+=11H++2MnO4-+5IO3-+7H2O.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
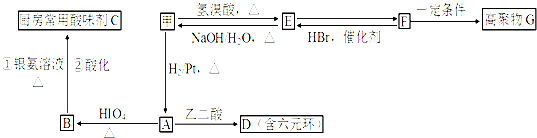
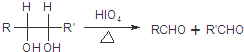
 .
.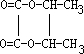 .
.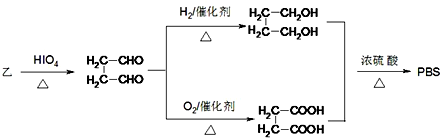
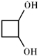 ,PBS的结构简式是
,PBS的结构简式是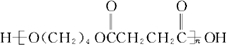 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
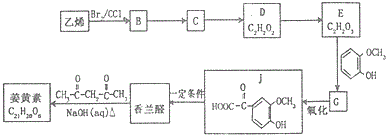

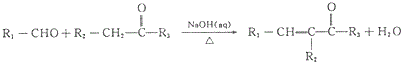 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子)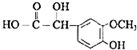 .
.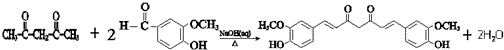 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>B>C>D | B. | 离子半径:A+>B2+>C->D2- | ||
| C. | 氢化物稳定性:H2D>HC | D. | 金属性:A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl是还原产物 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | 每生成1molNa2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用淀粉溶液检验加碘盐中是否含碘元素 | |
| B. | 水晶、玛瑙的主要成分是二氧化硅 | |
| C. | “白色污染”是指由不可降解的塑料造成的环境污染 | |
| D. | 硫和氮的氧化物是形成酸雨的主要物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com